1924 - USO CLÍNICO DEL CEFTOBIPROL: EXPERIENCIA EN LA PRÁCTICA CLÍNICA HABITUAL EN UN HOSPITAL TERCIARIO
Hospital Clínico Universitario de Valencia, Valencia, España.
Objetivos: El ceftobiprol es una cefalosporina de quinta generación, activa frente a cocos gram positivos, incluyendo SAMR, y bacilos gram negativos, incluyendo P. aeruginosa no multirresistente, aprobado para neumonía no asociada a ventilación tras los ensayos clínicos pivotales. El objetivo del estudio es analizar la eficacia y seguridad del ceftobiprol según en práctica clínica habitual en un hospital terciario.
Métodos: Se diseñó un estudio descriptivo retrospectivo incluyendo pacientes hospitalizados en nuestro centro, que recibieron tratamiento con ceftobiprol durante al menos 72 horas, desde septiembre de 2020 hasta diciembre de 2023.
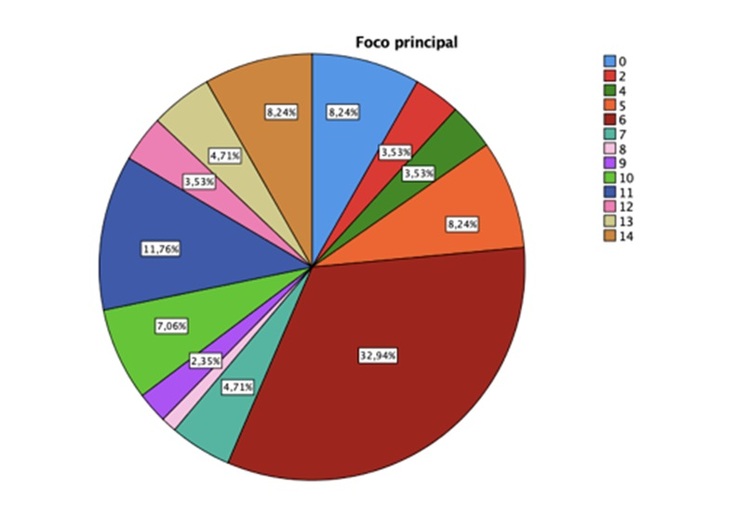
Resultados: Fueron incluidos 85 pacientes, con media de edad de 64,5 años (DE 1,76) y el 60% fueron hombres. Los datos epidemiológicos y clínicos se recogen en la tabla 1, destacando que el 30,6% presentaba inmunosupresión, en un 53% la infección fue nosocomial y en un 25,9% asociada a dispositivos. La mediana de la duración del ingreso fue de 21 días (RIC 25). En cuanto a la gravedad, un 12,9% presentó criterios de sepsis, el 5% con shock y el 11,8% de fracaso renal agudo. El foco de la infección más prevalente fue respiratorio (32, %), seguido de infecciones de herida quirúrgica (11,8%), artritis séptica (9,4%) e infecciones de piel y partes blandas (8,2%) (fig.). Se objetivó colonización por bacterias multirresistentes en un 25,9% de los pacientes y aislamiento microbiológico del proceso en 40 pacientes (47,1%,) siendo un 31,7% polimicrobiana. De los aislamientos, 31,8% fueron cocos gram positivos, 9 de ellos S. aureus (5 resistentes a la meticilina) y un 11,8%, bacilos gram negativos, de los cuales 5 fueron P. aeruginosa. La mediana de la duración del tratamiento antibiótico fue de 31 días y del ceftobiprole 7 días. En cuanto a seguridad, solo 4 individuos presentaron reacciones adversas, 3 leves (75%) y 1 grave (25%), siendo motivo de finalización del tratamiento en 2 casos. Valorando la evolución clínica, un 75,3% presentaron buena evolución, confirmándose curación microbiológica en un 24,7%. Sin embargo, 13 pacientes (15,3%) presentaron mala respuesta y fallecieron, y en meses posteriores, 10 pacientes presentaron recidiva (11,8%). Se realizó un análisis por subgrupos, en el cual las variables relacionadas con un aumento de la mortalidad fueron: antecedentes de insuficiencia cardíaca, hepatopatía grave e inmunosupresión, colonización por bacterias multirresistentes, la necesidad de tratamiento posterior, presencia de shock y de fallo renal (tabla 2). Finalmente, se realizó un análisis multivariable ajustado a dichas variables demostrando como factores asociados de forma significativa a mortalidad la inmunosupresión (OR 36,38 (IC95% 1,33-997,84) y la colonización por bacterias multirresistentes (OR 133,93 (IC95% 4,65-385,82)).
|
Tabla 1 |
|
|
Características epidemiológicas y clínicas |
(n = 85) |
|
Sexo (n, %) |
|
|
Hombres |
51 (60) |
|
Mujeres |
34 (40) |
|
Edad (media, DE) |
62,40 (± 1,76) |
|
Datos epidemiológicos |
|
|
Institucionalizados (n, %) |
2 (2,4) |
|
Inmunosupresión (n, %) |
26 (30,6) |
|
Barthel (media, DE) |
64,47 (7,3) |
|
Charlson (mediana, RIC) |
2 (4) |
|
Epidemiología de la infección |
|
|
Asociada a dispositivos (n, %) |
22 (25,9) |
|
Infección nosocomial o asociada a cuidados (n, %) |
46 (54) |
|
Datos de gravedad |
|
|
Sepsis (n, %) |
11 (12,9) |
|
Shock (n, %) |
5 (5,9) |
|
UCI (n, %) |
18 (21,2) |
|
FRA (n, %) |
10 (11,8) |
|
Bacteriemia (n, %) |
12 (14,1) |
|
Datos clínicos y terapéuticos |
|
|
Duración del ingreso (mediana, RIC) |
21 (25) |
|
Duración del tratamiento ATB (mediana, RIC) |
31 (69) |
|
Duración del tratamiento ceftobiprole (mediana, RIC) |
7 (7) |
|
Tratamiento previo (n, %) |
75 (88,2) |
|
Tratamiento combinado (n, %) |
68 (80) |
|
Tratamiento posterior (n, %) |
60 (70,6) |
|
Inicio de forma empírica (n, %) |
61 (71,8) |
|
Inicio de forma dirigida (n, %) |
24 (28,2) |
|
Datos microbiológicos |
|
|
Colonización previa |
|
|
Bacterias multirresistentes (n, %) |
13 (15,3) |
|
MARSA (n, %) |
2 (2,4) |
|
Pseudomonas aeruginosa (n, %) |
7 (8,2) |
|
Aislamientos disponibles (n, %) |
40 (47,1) |
|
Monomicrobiana (n, %) |
27 (67,5) |
|
Polimicrobiana (n, %) |
13 (31,7) |
|
Cocos gram positivos |
27 (31,8) |
|
S. aureus |
9 (10,6) |
|
SAMR |
5 (5,9) |
|
SAMS |
4 (4,7) |
|
SCN |
12 (14,1) |
|
Enterococos |
3 (3,5) |
|
Estreptococos |
1 (1,2) |
|
Otros CGP |
2 (2,4) |
|
Bacilos gram negativos |
10 (11,8) |
|
Pseudomonas aeruginosa |
5 (5,9) |
|
Klebsiella pneumoniae |
3 (3,5) |
|
Escherichia coli |
1 (1,2) |
|
Otros BGN |
1 (1,2) |
|
Hongos |
1 (1,2) |
|
Otros |
1 (1,2) |
|
Evolución |
|
|
Buena evolución (n, %) |
64 (75,3) |
|
Curación microbiológica (n, %) |
|
|
Curación (n, %) |
21 (24,7) |
|
No curación (n, %) |
8 (9,4) |
|
No comprobada (n, %) |
56 (65) |
|
Exitus hospitalario (n, %) |
13 (15,3) |
|
Atribuible al proceso infeccioso (n, %) |
11 (84,6) |
|
Exitus a los 6 meses (n, %) |
7 (8,2) |
|
Atribuible al proceso infeccioso (n, %) |
1 (14,3) |
|
Recidiva en los 3 o 12 meses posteriores |
10 (11,8) |
|
Reingreso en los 3 o 12 meses posteriores |
27 (31,7) |
|
Atribuible al proceso infeccioso (n, %) |
9 (33,3) |
|
Tabla 2. Análisis de variables por subgrupos |
||||
|
Variables |
Supervivientes (n = 72) |
No supervivientes (n = 13) |
Análisis univariante (p) |
Análisis multivariante (OR, IC95%) |
|
Sexo (n, %) |
41 |
10 |
0,227 |
|
|
Edad (media, DE) |
61,04 (16,4) |
69,9 (13,5) |
0,116 |
1,074 (0,96-1,20) |
|
Institucionalizado (n, %) |
2 (27,8) |
0 (0) |
1 |
|
|
Barthel (media, DE) |
67,22 (36,3) |
49,23 (45,5) |
0,136 |
0,974 (0,04-1,01) |
|
Inmunosupresión (n, %) |
19 (26,3) |
7 (53,8) |
0,098 |
36,38 (1,33-997,84) |
|
Charlson (mediana, RIC) |
2 (4) |
4 (3) |
0,136 |
|
|
HTA (n, %) |
36 (50) |
7 (53,8) |
1 |
|
|
DM (n, %) |
16 (22,2) |
4 (30,7) |
0,494 |
|
|
DM con lesión (n, %) |
8 (11,1) |
0 (0) |
0,349 |
|
|
ERC (n, %) |
8 (11,1) |
2 (15,4) |
0,646 |
|
|
C. isquémica (n, %) |
7 (9,7) |
2 (15,4) |
0,622 |
|
|
ICC (n, %) |
8 (11,1) |
5 (38,4) |
0,025* |
12,23 (0,544-275,27) |
|
EAP (n, %) |
5 (6,9) |
1 (7,6) |
1 |
|
|
Enf. pulmonar (n, %) |
15 (67,5) |
3 (23,1) |
1 |
|
|
Enf. cerebrovascular (n, %) |
5 (6,9) |
0 (0) |
1 |
|
|
Demencia (n, %) |
3 (4,2) |
2 (15,4) |
0,166 |
|
|
Hemiplejía (n, %) |
4 (5,5) |
1 (7,6) |
0,573 |
|
|
Conectivopatía (n, %) |
3 (4,2) |
0 (0) |
1 |
|
|
Ulcus (n, %) |
2 (2,7) |
0 (0) |
1 |
|
|
Hepatopatía grave (n, %) |
0 (0) |
2 (15,4) |
0,022* |
|
|
Hepatopatía leve (n, %) |
3 (4,2) |
1 (7,6) |
0,492 |
|
|
Neoplasia sin metástasis (n, %) |
6 (8,3) |
1 (7,6) |
1 |
|
|
Neoplasia con metástasis (n, %) |
4 (5,5) |
1 (7,6) |
0,573 |
|
|
Leucemia (n, %) |
1 (1,4) |
0 (0) |
1 |
|
|
Linfoma (n, %) |
2 (2,7) |
2 (15,4) |
0,109 |
|
|
SIDA (n, %) |
3 (4,2) |
0 (0) |
1 |
|
|
FRA (n, %) |
6 (8,3) |
4 (30,7) |
0,042* |
1,56 (0,025-96,13) |
|
Bacteriemia (n, %) |
10 (13,8) |
2 (15,4) |
0,585 |
|
|
Sepsis (n, %) |
7 (9,7) |
4 (30,7) |
0,082 |
0,94 (0,029-30,39) |
|
Shock (n, %) |
2 (2,7) |
3 (23,1) |
0,032* |
65,33 (0,10-418,95) |
|
Tto. empírico (n, %) |
17 (23,6) |
7 (53,8) |
0,042 |
|
|
Tto. previo (n, %) |
65 (90,3) |
10 (76,9) |
0,029 |
|
|
Tto. posterior (n, %) |
55 (76,4) |
5 (38,4) |
0,016* |
0,214 (0,02-2,99) |
|
Infección polimicrobiana |
9 (12,5) |
4 (30,7) |
0,107 |
|
|
Tiempo ceftobiprol (mediana, RIC) |
7 (7) |
9 (7) |
0,471 |
|
|
Colonización multirresistentes (n, %) |
6 (8,3) |
7 (53,8) |
< 0,001* |
133,93 (4,65-385,82) |
|
Colonización SARM (n, %) |
1 (1,4) |
1 (7,6) |
0,284 |
|
|
Colonización P. aeruginosa (n, %) |
5 (6,9) |
2 (15,4) |
0,290 |
|
Conclusiones: En este estudio se objetiva la efectividad del ceftobiprol en la práctica habitual en infecciones de diferentes focos, origen y gravedad, permitiendo evitar el uso de antibioterapia de mayor impacto ecológico y posicionándose como alternativa a estos más allá de lo demostrado en ensayos clínicos. Sin embargo, en pacientes con riesgo de mala evolución, como inmunosuprimidos y aquellos colonizados con bacterias multirresistentes deberían contemplarse otras opciones terapéuticas dado el aumento de riesgo de su mortalidad. El uso de ceftobiprol no produjo RAM graves, resultando un tratamiento seguro.






