1515 - INTEGRACIÓN DE MUTACIONES GENÉTICAS EMERGENTES Y EPIDEMIOLOGÍA EN PACIENTES CON ENFERMEDAD TROMBOEMBÓLICA VENOSA
1Hospital General Universitario Gregorio Marañón, Madrid, España. 2Instituto de Investigación Sanitaria Gregorio Marañón (IiSGM), Madrid, España. 3Universidad Complutense de Madrid, Madrid, España. 4Complejo Hospitalario Universitario de Santiago, Santiago de Compostela, España. 5Universidad Autónoma de Madrid, Madrid, España.
Objetivos: Describir la presencia de polimorfismos genéticos emergentes incluidos en la escala Thrombo inCode (TiC)® y su implicación terapéutica en pacientes adultos con edades entre los 18 y los 50 años diagnosticados de ETV no provocada o asociada a factores provocadores menores, ETV recurrente o trombosis venosa en lugares inusuales.
Métodos: Estudio observacional prospectivo con pacientes entre 18 y 50 años diagnosticados de un primer episodio de ETV no provocada, recurrente o en lugares inusuales en un hospital de tercer nivel entre junio de 2021 y agosto de 2023, identificando en una muestra de sangre periférica los polimorfismos incluidos en la escala TiC. Se utiliza para todos los cálculos el paquete estadístico IBM SPSS Statistics para Windows, versión 21.0. Armonk, NY: IBM Corp.
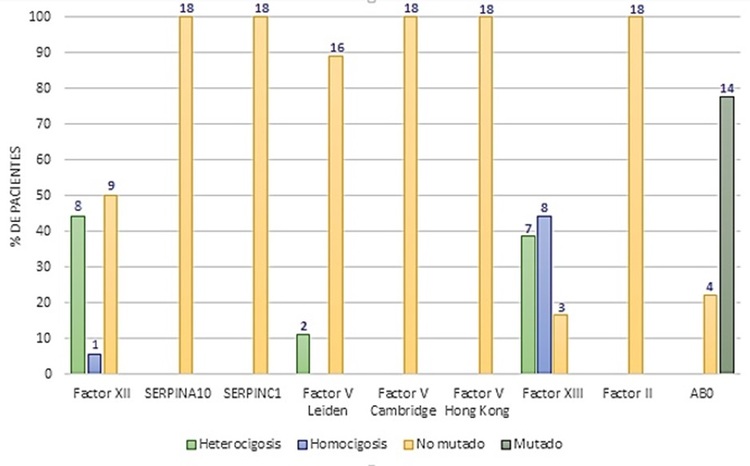
Resultados: Se incluyen 18 pacientes (tabla 1), de los cuales doce presentaron ETV no provocada, tres ETV recurrente y tres trombosis en lugares inusuales. Trece pacientes (72,2%) eran mujeres y la edad media fue de 42,5 años. Catorce pacientes (77,8%) presentaron haplotipos de riesgo del gen ABO. La mutación rs5985 del factor XIII se encontró en siete pacientes (38,8%) de forma heterocigota y en ocho pacientes (44,4%) de forma homocigota. El polimorfismo rs1801020 del factor XII se objetivó en ocho pacientes (44,4%) en heterocigosis y en un paciente (5,6%) en homocigosis. Dos pacientes (11,1%) presentaron la mutación rs6025 del Factor V Leiden en heterocigosis, sin portadores en homocigosis, ni de la mutación G20210A del gen de la protrombina. Los polimorfismos rs121909548 del gen SERPINC1, rs2232698 del gen SERPINA10, rs118203905 del gen del Factor V (Cambridge) y el rs118203906 del gen del Factor V (Hong Kong) tampoco se observaron en la muestra (fig.). El estudio de trombofilias genéticas convencional influyeron en el tratamiento de dos pacientes (11,1%), mientras que el estudio de nuevas variantes genéticas no tuvo implicaciones terapéuticas en ninguno.
Discusión: El estudio de la trombofilia heredable se ha evaluado clásicamente determinando la actividad de proteínas naturales de la coagulación, la mutación del factor V Leiden y la mutación G20210A de la protrombina. Soria et al propusieron una escala clínico-genética que incluyó 13 “single-nucleotide polymorphisms” y que fue capaz de obtener la mayor capacidad predictiva para ETV que el resto de paneles evaluados1. Nuestro estudio muestra una importante representación de estas variantes genéticas en la muestra seleccionada (tabla 2), pero su determinación no tiene implicaciones terapéuticas en ningún paciente. Es el primer estudio hasta la fecha que evalúa la incidencia de estas nuevas variantes genéticas en los pacientes con ETV donde el estudio de trombofilia se encuentra especialmente recomendado, y también en evaluar eventos clínicos durante un tiempo de seguimiento en estos pacientes.
|
Tabla 1 |
||||
|
Variables |
ETV no provocada (n = 12) |
ETV recurrente (n = 3) |
Trombosis en sitios inusuales (n = 3) |
Total (n = 18) |
|
Edad, años media (DE) |
39,5 (11,11) |
39 (6,08) |
37,67 (15,31) |
39,11 (10,59) |
|
Sexo mujer |
9 (75) |
1 (33,3) |
3 (100) |
13 (72,2) |
|
Antecedentes personales |
||||
|
Hipertensión arterial, n (%) |
1 (8,3) |
1 (33,3) |
0 |
2 (11,1) |
|
Diabetes tipo 2, n (%) |
- |
- |
- |
- |
|
Dislipemia, n (%) |
1 (8,3) |
0 |
0 |
1 (5,6) |
|
Obesidad, n (%) |
8 (66,7) |
1 (33,3) |
2 (66,7) |
11 (61,1) |
|
Tabaquismo, n (%) |
6 (50) |
2 (66,7) |
0 |
8 (44,4) |
|
Hábito enólico, n (%) |
- |
- |
- |
- |
|
Historia familiar de ETV, n (%) |
3 (25) |
1 (33,3) |
1 (33,3) |
5 (27,8) |
|
Anemia crónica, n (%) |
1 (8,3) |
0 |
1 (33,3) |
2 (11,1) |
|
Cardiopatía isquémica, n (%) |
- |
- |
- |
- |
|
Insuficiencia cardíaca, n (%) |
- |
- |
- |
- |
|
Accidente cerebrovascular, n (%) |
0 |
1 (33,3) |
0 |
1 (5,6) |
|
Enfermedad arterial Periférica, n (%) |
- |
- |
- |
- |
|
Enfermedad renal crónica, n (%) |
- |
- |
- |
- |
|
Hepatopatía crónica, n (%) |
- |
- |
- |
- |
|
Factores provocadores menores de ETV |
||||
|
Toma activa de ACHO, n (%) |
4(33,3) |
0 |
2 (66,7) |
6 (33,3) |
|
Inmovilización relativa, n (%) |
1 (8,3) |
0 |
0 |
1 (5,6) |
|
Trombofilia hereditaria previamente conocida |
||||
|
Síndrome antifosfolípido, n (%) |
- |
- |
- |
- |
|
Déficit de antitrombina III, n (%) |
- |
- |
- |
- |
|
Déficit de proteína C, n (%) |
- |
- |
- |
- |
|
Déficit de proteína S, n (%) |
- |
- |
- |
- |
|
Mutación del factor V Leiden, n (%) |
- |
- |
- |
- |
|
Mutación del gen G20210A de la protrombina, n (%) |
- |
- |
- |
- |
|
Diagnósticos concomitantes al episodio de ETV |
||||
|
Cáncer activo, n (%) |
0 |
0 |
1 (33,3) |
1 (5,6) |
|
Tabla 2 |
||||
|
|
No provocada (n = 12) |
Recurrente (n = 3) |
Sitios inusuales (n = 3) |
Total(n = 18) |
|
F12 en heterocigosis, n (%) |
5 (41,7%) |
2 (66,7%) |
1 (33,3%) |
8 (44,4%) |
|
F12 en homocigosis, n (%) |
1 (8,3%) |
0 |
0 |
1 (5,6%) |
|
Grupo ABO haplotipo de riesgo, n (%) |
11 (91,7%) |
2 (66,7%) |
1 (33,3%) |
14 (77,8%) |
|
SERPINA10 en heterocigosis, n (%) |
0 |
0 |
0 |
0 |
|
SERPINA10 en homocigosis, n (%) |
0 |
0 |
0 |
0 |
|
SERPINC1 en heterocigosis, n (%) |
0 |
0 |
0 |
0 |
|
SERPINC1 en homocigosis, n (%) |
0 |
0 |
0 |
0 |
|
FV Leiden en heterocigosis, n (%) |
2 (16,7%) |
0 |
0 |
2 (11,1%) |
|
FV Leiden en homocigosis, n (%) |
0 |
0 |
0 |
0 |
|
FV Cambridge en heterocigosis, n (%) |
0 |
0 |
0 |
0 |
|
FV Cambridge en homocigosis, n (%) |
0 |
0 |
0 |
0 |
|
FV Hong Kong en heterocigosis, n (%) |
0 |
0 |
0 |
0 |
|
FV Hong Kong en homocigosis, n (%) |
0 |
0 |
0 |
0 |
|
Factor 13 en heterocigosis, n (%) |
5 (41,7%) |
2 (66,7%) |
0 |
7 (38,9%) |
|
Factor 13 en homocigosis, n (%) |
4 (33,3%) |
1 (33,3%) |
3 (100%) |
8 (44,4%) |
|
Mutación F2 en heterocigosis, n (%) |
0 |
0 |
0 |
0 |
|
Mutación F2 en homocigosis, n (%) |
0 |
0 |
0 |
0 |
Conclusiones: Los pacientes jóvenes con ETV no provocada, ETV recurrente o en lugares inusuales presentan frecuentemente polimorfismos asociados con un mayor riesgo de ETV. Son necesarios más estudios que evalúen la implicación terapéutica de estos nuevos polimorfismos de riesgo de ETV.
Bibliografía
1. Soria JM, Morange PE, Vila J, et al. Multilocus genetic risk scores for venous thromboembolism risk assessment. J Am Heart Assoc. 2014;3(5):e001060.








