A pesar de los tratamientos actuales, el riesgo de muerte y hospitalizaciones en pacientes con insuficiencia cardíaca con fracción de eyección reducida (IC-FEr) sigue siendo elevado. La fisiopatología de la IC-FEr incluye activación neurohormonal caracterizada por la estimulación de las vías deletéreas (sistemas simpático y renina-angiotensina-aldosterona) y la supresión de las vías protectoras como las dependientes del óxido nítrico. La inhibición o estimulación de algunas de estas vías, pero no de todas, es insuficiente. En la IC-FEr existe una menor actividad de óxido nítrico, guanilato ciclasa soluble y GMPc que provoca efectos deletéreos a nivel miocárdico, vascular y renal. Vericiguat estimula la actividad de esta vía protectora. El estudio VICTORIA demostró, en pacientes con IC-FEr y descompensación reciente, que la adición de vericiguat al tratamiento médico óptimo reducía de forma significativa la incidencia del objetivo primario compuesto de muerte cardiovascular u hospitalización por IC, con un número de 24 pacientes que es necesario tratar, y una excelente tolerabilidad.
Despite currently available treatments, risk of death and hospitalizations in patients with heart failure with reduced ejection fraction (HFrEF) remains high. The pathophysiology of HFrEF includes neurohormonal activation characterized by stimulation of deleterious pathways (i.e., sympathetic nervous and renin-angiotensin-aldosterone systems) and suppression of protective pathways such as nitric oxide-dependent pathways. Inhibition or stimulation of some, but not all, of these pathways is insufficient. In HFrEF, there is reduced nitric oxide, soluble guanylate cyclase, and cGMP activity, leading to deleterious effects in the myocardial, vascular, and renal systems. Vericiguat is able to stimulate the activity of this protective pathway. The VICTORIA study demonstrated that the addition of vericiguat to optimal medical treatment in patients with HFrEF and recent decompensation significantly reduced the incidence of the primary endpoint, a composite of cardiovascular death or HF hospitalization, with a number needed to treat of 24 patients and excellent tolerability.
La insuficiencia cardíaca (IC) es una entidad frecuente, con una prevalencia estimada en los países desarrollados en torno al 2% de la población adulta, si bien se espera que aumente en los próximos años, principalmente por el envejecimiento de la población1–5.
La IC se asocia con una elevada morbimortalidad6–9. Además, la hospitalización por IC es un factor predictor de mortalidad1,10. Igualmente, la IC tiene un marcado impacto negativo sobre la calidad de vida de los pacientes11. Asimismo, los costes asociados a la IC son muy elevados, siendo la hospitalización el principal componente12,13. Afortunadamente, la optimización del tratamiento se asocia con una reducción del coste sanitario14.
La IC con fracción de eyección reducida (IC-FEr) es una enfermedad progresiva, con un deterioro gradual de la función cardíaca a lo largo del tiempo, en el que se intercalan períodos de descompensación aguda, que empeoran aún más el pronóstico del paciente15,16. Aproximadamente uno de cada 6 pacientes con IC-FEr desarrollarán un empeoramiento en los siguientes 18 meses tras el diagnóstico de IC16. Asimismo, el empeoramiento crónico de la IC supone el 80% de las hospitalizaciones por IC17. Además de empeorar el pronóstico, cada vez que el paciente presenta un ingreso hospitalario, estos suelen ser cada vez más graves y prolongados, y el tiempo entre las descompensaciones menor18,19.
En consecuencia, es necesario optimizar el tratamiento para tratar de disminuir la carga de enfermedad que supone la IC16,20–22. Pero, para ello, es imprescindible comprender que la etiopatogenia de la IC es un proceso complejo, en la que intervienen numerosos sistemas neurohormonales. Por lo tanto, el manejo terapéutico debe centrarse en el tratamiento de los diferentes sistemas neurohormonales de manera global (tabla 1)23–29.
Etiopatogenia de la insuficiencia cardíaca y tratamientos potenciales
| Sistemas implicados | Mecanismo implicado en la IC | Fármaco/s potencial/es |
|---|---|---|
| Sistema renina-angiotensina-aldosterona | Activación | Inhibidores sistema renina-angiotensina-aldosterona: IECA, ARA II, antagonistas de la aldosterona |
| Sistema nervioso simpático | Activación | Betabloqueantes |
| Péptidos natriuréticos | Inhibición | Inhibidores de la neprilisina: activación péptidos natriuréticos |
| SGLT-2 | Activacióna | Inhibidores SGLT-2a |
| Guanilato ciclasa | Inhibición | Activación guanilato ciclasa: vericiguat |
ARA II: antagonistas de los receptores de angiotensina II; IC: insuficiencia cardíaca; IECA: inhibidores de la enzima convertidora de angiotensina; SGLT-2: cotransportador de sodio-glucosa tipo 2.
No se conocen bien los mecanismos por los que los inhibidores SGLT-2 ofrecen un mecanismo cardioprotector. Se incluyen factores hemodinámicos, control de la estimulación simpática, inhibición de la fibrosis y del remodelado cardíaco, mejora del gasto cardíaco, modulación de las concentraciones citosólicas de sodio y calcio y alteraciones de los niveles de adipocinas.
Adaptada de Triposkiadis et al.23, McDonagh et al.24, Maddox et al.25, McDonald et al.26, Matsumura y Sugiura27, Armstrong et al.28 y Nightingale29.
De hecho, en un reciente estudio que analizó los resultados combinados de varios ensayos clínicos, en comparación con el empleo de inhibidores de la enzima convertidora de angiotensina/antagonistas de los receptores de angiotensina II más betabloqueantes, el tratamiento con sacubitrilo/valsartán, betabloqueantes, antagonistas de la aldosterona y los inhibidores del cotransportador sodio-glucosa tipo 2 (SGLT-2) se asoció con reducciones significativas de los eventos cardiovasculares30.
En consecuencia, es necesario iniciar de manera precoz todos aquellos fármacos que hayan demostrado que mejoran el pronóstico y, de esta forma, disminuir los eventos cardiovasculares en los pacientes con IC31. Desafortunadamente, un porcentaje sustancial de pacientes con IC no está tomando la combinación de tratamientos recomendados, lo que se asocia con un incremento en el riesgo de presentar complicaciones32.
Tradicionalmente las guías de práctica clínica de IC habían presentado un enfoque vertical del tratamiento, añadiendo/modificando el tratamiento si persisten los síntomas33. Sin embargo, este planteamiento supone un retraso en la optimización del tratamiento, lo que potencialmente podría suponer un peor pronóstico a largo plazo34,35.
En cambio, las nuevas recomendaciones han cambiado este enfoque, pasando de un planteamiento secuencial y «vertical» del tratamiento, a uno más «transversal», con el objetivo, precisamente, de que el paciente obtenga el máximo beneficio desde el principio24–26. Así, las últimas guías europeas de IC del año 2021 recomiendan en pacientes sintomáticos con IC-FEr, de primera línea, el empleo de sacubitrilo/valsartán o inhibidores de la enzima convertidora de angiotensina, betabloqueantes, antagonistas de la aldosterona e inhibidores SGLT-2, y, de segunda línea, el uso de vericiguat.
De hecho, las guías europeas de IC señalan que se debería considerar el tratamiento con vericiguat en pacientes sintomáticos, que presenten empeoramiento de IC a pesar de los tratamientos de primera línea para reducir el riesgo de muerte cardiovascular u hospitalización por IC (recomendación IIb, nivel de evidencia B)24. La Agencia Europea del Medicamento ha aprobado vericiguat para el tratamiento de la IC crónica sintomática en pacientes adultos con IC-FEr que están estabilizados después de un episodio reciente de descompensación que requirió tratamiento diurético por vía intravenosa36. Sin embargo, es importante destacar que, a pesar de los tratamientos de primera línea, el riesgo residual de eventos sigue siendo elevado37.
Por lo tanto, sigue siendo necesario el empleo de nuevos tratamientos, como vericiguat, que actúen sobre vías fisiopatológicas complementarias, que ayuden a disminuir la carga de enfermedad que supone la IC.
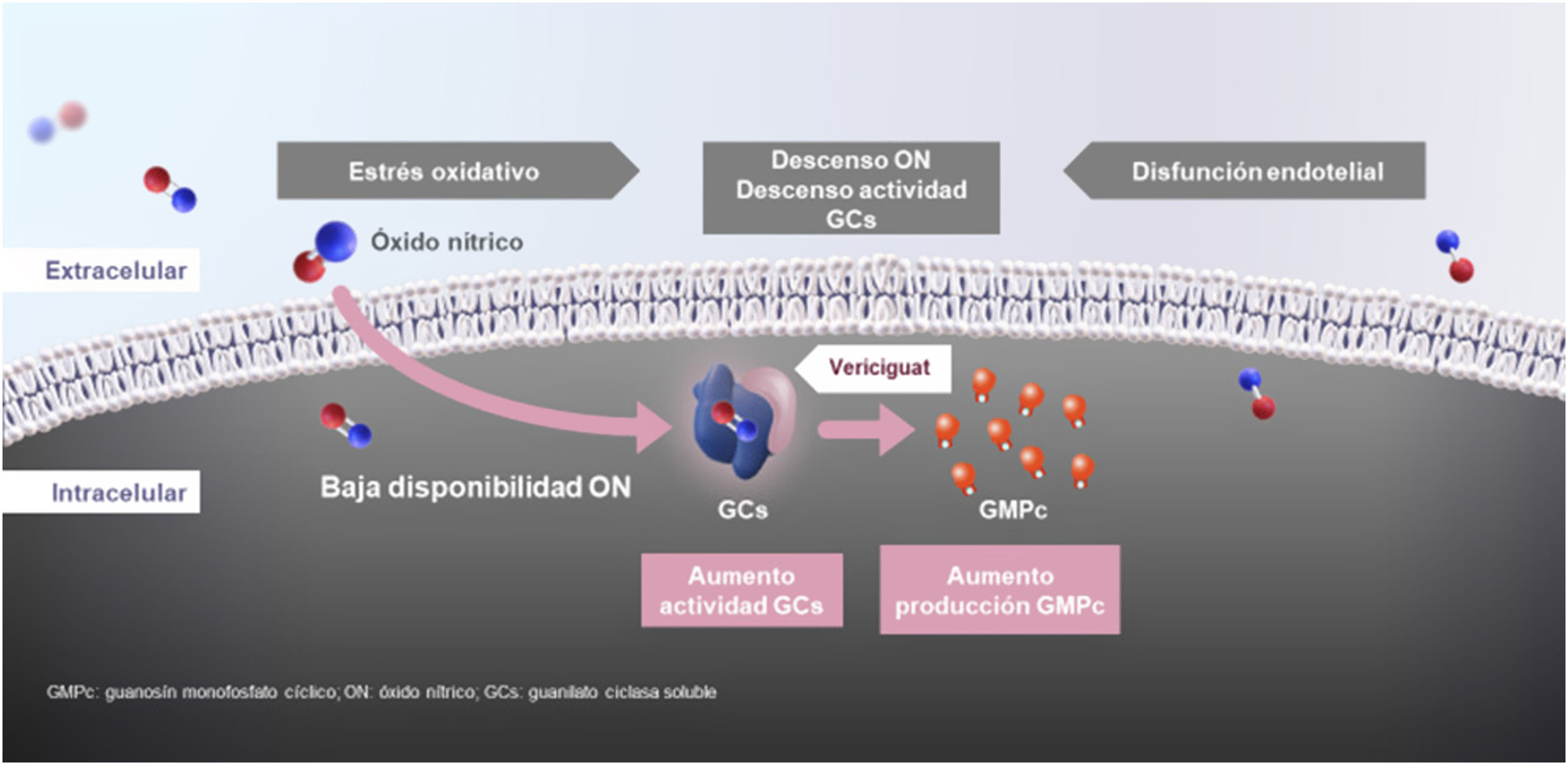
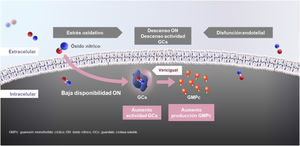
Vericiguat: mecanismo de acción y parámetros farmacocinéticosEn la IC existe una alteración de la síntesis del óxido nítrico, así como una disminución de la actividad de su receptor, la guanilato ciclasa soluble (GCs), lo que a su vez provoca una deficiencia del guanosín monofosfato cíclico (GMPc). La deficiencia de GMPc provoca un deterioro de la función miocárdica, vascular y renal. Ninguno de los tratamientos actuales de la IC (betabloqueantes, inhibidores del sistema renina-angiotensina, inhibidores SGLT-2) actúan por esta vía.
Vericiguat es un fármaco oral que estimula de manera directa la GCs, lo que aumenta la disponibilidad de GMPc intracelular, y de esta forma produce efectos beneficiosos, restableciendo la deficiencia relativa en la vía de señalización óxido nítrico-GCs-GMPc mediante la estimulación directa de la GCs, de forma independiente y sinérgica con el óxido nítrico.
El aumento de GMPc se traduce en una reducción del remodelado del ventrículo izquierdo, en una mejoría de la función miocárdica y vascular, además de en un descenso de la fibrosis y la inflamación (fig. 1)36,38–45. En consecuencia, a diferencia de otros fármacos que inhiben determinadas vías deletéreas que se encuentran activadas, como el sistema renina-angiotensina-aldosterona o el sistema nervioso simpático, vericiguat y sacubitrilo estimulan las vías protectoras (sistema óxido nítrico-GCs-GMPc y péptidos natriuréticos, respectivamente) (tabla 1)23–29.
En cuanto a la farmacocinética, la biodisponibilidad absoluta de vericiguat es elevada cuando se toma con alimentos (93%), por lo que se recomienda su toma con los mismos. La unión a proteínas plasmáticas es de aproximadamente el 98%, principalmente con la albúmina. Con respecto al metabolismo, la glucuronidación a través de UGT1A9 y UGT1A1 es la vía principal de biotransformación, mientras que el metabolismo mediado por el citocromo P 450 es pequeño (<5%), por lo que el riesgo de interacciones farmacocinéticas con otros fármacos es bajo.
No obstante, está contraindicado el empleo concomitante de vericiguat con otros estimuladores de la GCs, como riociguat. La vida media en los sujetos sanos es de unas 20h, llegando hasta 30h en los pacientes con IC. Aproximadamente el 53% se excreta en la orina y el 45% en las heces. No es necesario ajustar la dosis en función de la edad, el sexo, la raza, el peso corporal, o los niveles basales de péptidos natriuréticos. Tampoco es necesario ajustar la dosis en sujetos con un filtrado glomerular≥15mL/min/1,73m2, o con insuficiencia hepática leve o moderada. Sin embargo, no se ha estudiado el uso de vericiguat en sujetos con enfermedad renal más avanzada o insuficiencia hepática grave36,46–50.
Desarrollo clínico de vericiguatEn el desarrollo clínico de vericiguat destacan principalmente 4 ensayos clínicos, 2 en fase II (SOCRATES [SOluble guanylate Cyclase stimulatoR in heArT failurE Study]-REDUCED y SOCRATES-PRESERVED) y 2 en fase III (VICTORIA [Vericiguat Global Study in Subjects with Heart Failure with Reduced Ejection Fraction] y VITALITY [Evaluate the Efficacy and Safety of the Oral sGC Stimulator Vericiguat to Improve Physical Functioning in Daily Living Activities of Patients with Heart Failure and Preserved Ejection Fraction]).
El programa fase II SOCRATES está formado por 2 ensayos clínicos, multicéntricos, de grupos paralelos y controlados con placebo: el estudio SOCRATES-REDUCED, en pacientes con FEVI<45% y el SOCRATES-PRESERVED, en sujetos con FEVI≥45%, que analizaron los efectos farmacodinámicos, farmacocinéticos, seguridad y tolerabilidad de 4 dosis diferentes de vericiguat durante 12 semanas, al alta o tras 4 semanas de una hospitalización por IC. La variable primaria del estudio SOCRATES-REDUCED fue el cambio en los niveles de propéptido natriurético cerebral N-terminal (NT-proBNP), y del SOCRATES-PRESERVED, el cambio en los niveles de NT-proBNP y el volumen de la aurícula izquierda, tras 12 semanas de tratamiento51.
En el estudio SOCRATES-REDUCED se incluyeron a 456 pacientes: 92 en el grupo placebo y 91 en cada grupo de vericiguat (1,25mg; 2,5mg; 5mg y 10mg). Aunque globalmente no hubo diferencias significativas con respecto a los cambios en los niveles de péptidos natriuréticos de vericiguat en comparación con placebo, sí se observó una relación de dosis respuesta de vericiguat (a mayor dosis, mayor reducción; p<0,02). Aunque este estudio no tenía potencia suficiente para valorar los eventos clínicos, las tasas de mortalidad y hospitalización por IC fueron numéricamente más bajas con vericiguat que con el placebo (11% y 12,1% con vericiguat 10mg y 5mg, respectivamente, frente a 19,6% en el grupo placebo). Además, la tolerancia de vericiguat fue buena52.
En el estudio SOCRATES-PRESERVED, si bien el tratamiento con vericiguat no se asoció con cambios significativos ni en los niveles de NT-proBNP, ni en el volumen de la aurícula izquierda, sí se observó una mejoría en la calidad de vida y en el estado de salud de los pacientes tratados con vericiguat, además de su buena tolerancia53,54.
El estudio VICTORIA fue un ensayo clínico fase III, aleatorizado, doble ciego, de grupos paralelos, controlado con placebo, realizado con el objetivo de evaluar los efectos de vericiguat en pacientes con IC crónica sintomática tras un evento de empeoramiento de IC.
Se incluyeron pacientes con IC-FEr (FEVI<45%), en clase funcional II-IV la New York Heart Association, niveles de péptidos natriuréticos elevados (péptido natriurético cerebral (BNP)≥300pg/mL o NT-proBNP≥1000pg/mL si ritmo sinusal; BNP≥500pg/mL o NT-proBNP≥1600pg/mL si fibrilación auricular), filtrado glomerular estimado≥15mL/min/1,73m2, y hospitalización por IC en los 6 meses previos o tratamiento diurético intravenoso (iv) para la IC en los 3 meses previos.
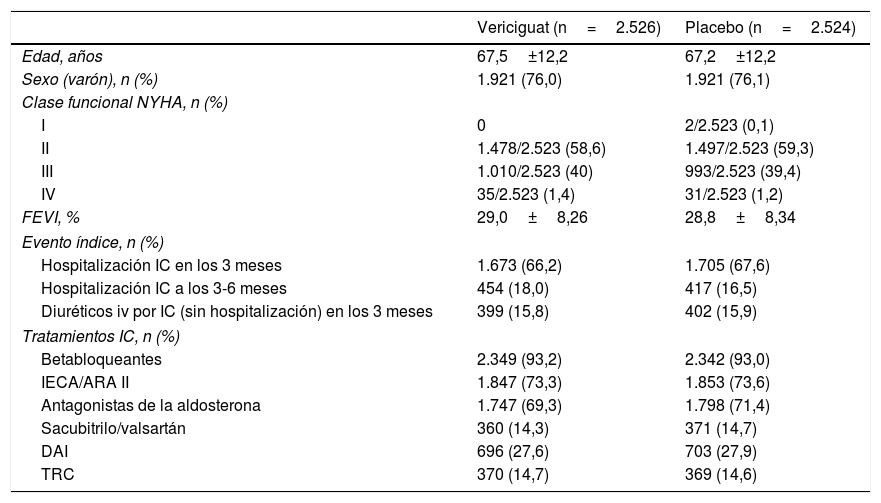
Los pacientes fueron aleatorizados para recibir vericiguat (dosis inicial 2,5mg una vez al día, dosis objetivo 10mg una vez al día) o placebo, añadidos a la terapia estándar de la IC. La variable primaria del estudio fue la combinación de muerte cardiovascular o primera hospitalización por IC55. Las características basales de los pacientes se muestran en la tabla 2. En el 89,2% de los casos se consiguió la dosis objetivo de vericiguat55.
Características basales del estudio VICTORIA
| Vericiguat (n=2.526) | Placebo (n=2.524) | |
|---|---|---|
| Edad, años | 67,5±12,2 | 67,2±12,2 |
| Sexo (varón), n (%) | 1.921 (76,0) | 1.921 (76,1) |
| Clase funcional NYHA, n (%) | ||
| I | 0 | 2/2.523 (0,1) |
| II | 1.478/2.523 (58,6) | 1.497/2.523 (59,3) |
| III | 1.010/2.523 (40) | 993/2.523 (39,4) |
| IV | 35/2.523 (1,4) | 31/2.523 (1,2) |
| FEVI, % | 29,0±8,26 | 28,8±8,34 |
| Evento índice, n (%) | ||
| Hospitalización IC en los 3 meses | 1.673 (66,2) | 1.705 (67,6) |
| Hospitalización IC a los 3-6 meses | 454 (18,0) | 417 (16,5) |
| Diuréticos iv por IC (sin hospitalización) en los 3 meses | 399 (15,8) | 402 (15,9) |
| Tratamientos IC, n (%) | ||
| Betabloqueantes | 2.349 (93,2) | 2.342 (93,0) |
| IECA/ARA II | 1.847 (73,3) | 1.853 (73,6) |
| Antagonistas de la aldosterona | 1.747 (69,3) | 1.798 (71,4) |
| Sacubitrilo/valsartán | 360 (14,3) | 371 (14,7) |
| DAI | 696 (27,6) | 703 (27,9) |
| TRC | 370 (14,7) | 369 (14,6) |
ARA II: antagonistas de los receptores de angiotensina II; DAI: desfibrilador automático implantable; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardíaca; IECA: inhibidores de la enzima convertidora de angiotensina; NYHA: New York Heart Association; TRC: terapia de resincronización cardíaca; iv: intravenoso.
Adaptada de Armstrong et al.55.
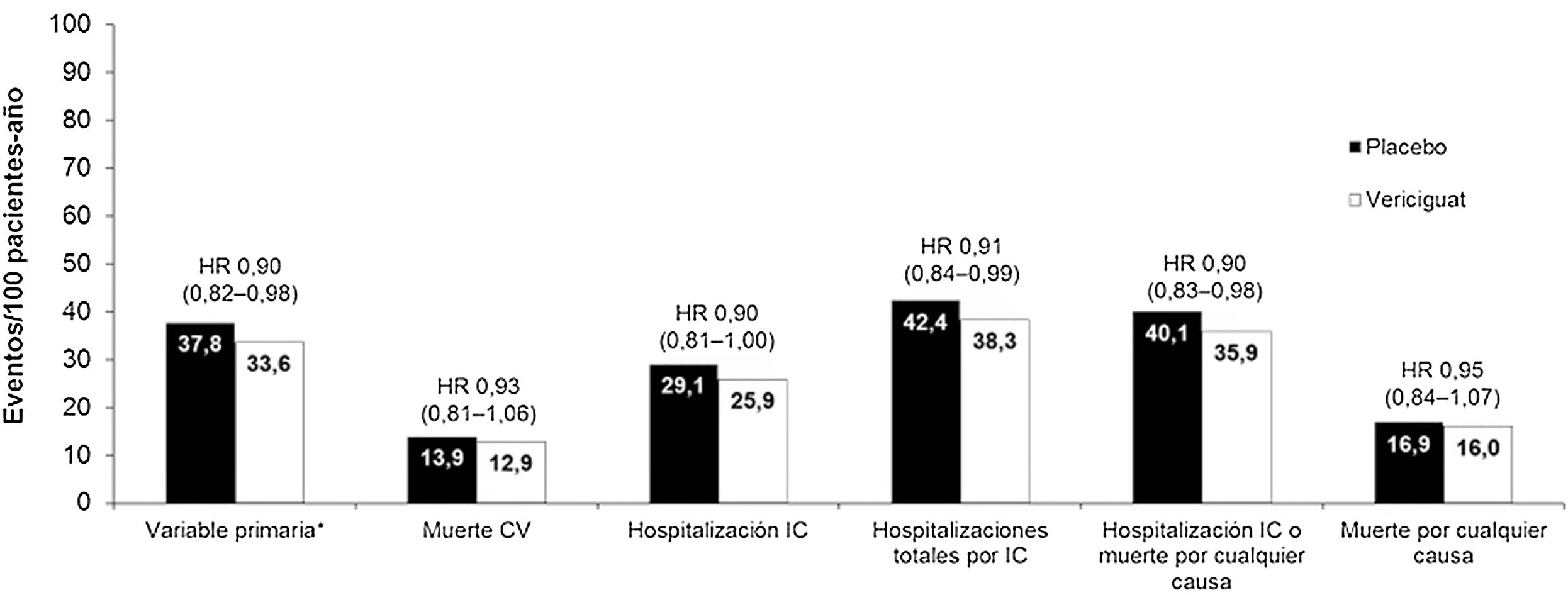
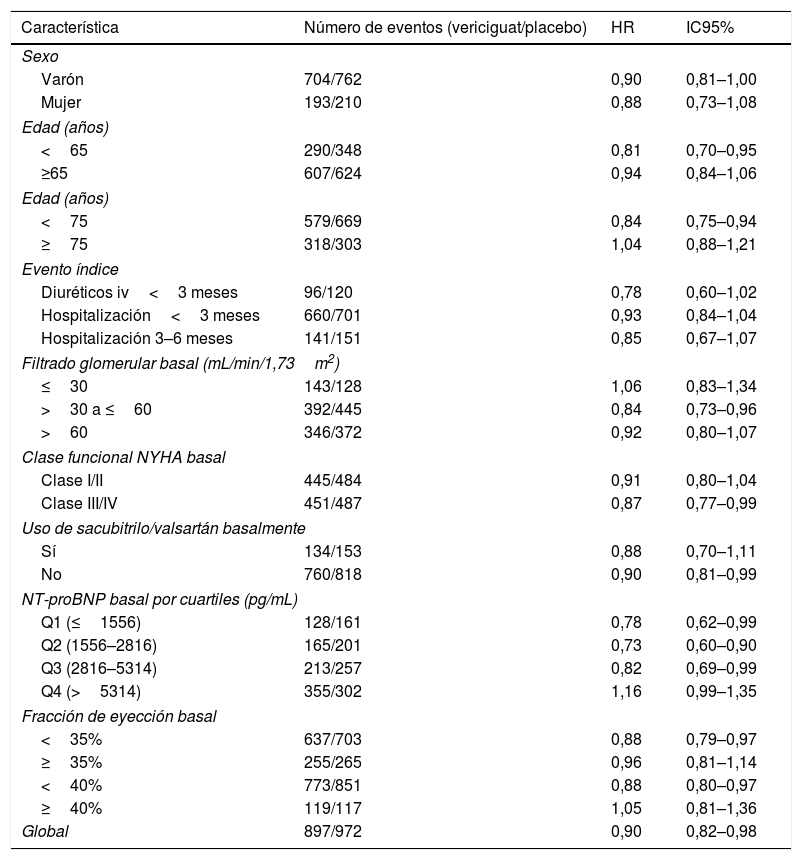
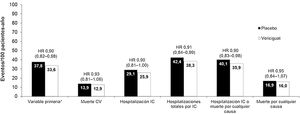
Tras una mediana de seguimiento de 10,8 meses, el tratamiento con vericiguat se asoció con una reducción significativa de la variable primaria del 10% (hazard ratio [HR] 0,90; intervalo de confianza 95% [IC95%] 0,82-0,98; p=0,02). Además, también se objetivaron con vericiguat reducciones significativas de las hospitalizaciones totales por IC y de la variable combinada hospitalización por IC o muerte por cualquier causa (fig. 2). Los resultados de la variable primaria fueron consistentes en los diferentes subgrupos de pacientes analizados (tabla 3)55.
Eventos principales en el estudio VICTORIA.
CV: cardiovascular; HR: hazard ratio; IC: insuficiencia cardíaca.
*Muerte cardiovascular o primera hospitalización por insuficiencia cardíaca.
Adaptada de Armstrong et al.55.
Análisis de subgrupos de la variable primaria en el estudio VICTORIA
| Característica | Número de eventos (vericiguat/placebo) | HR | IC95% |
|---|---|---|---|
| Sexo | |||
| Varón | 704/762 | 0,90 | 0,81–1,00 |
| Mujer | 193/210 | 0,88 | 0,73–1,08 |
| Edad (años) | |||
| <65 | 290/348 | 0,81 | 0,70–0,95 |
| ≥65 | 607/624 | 0,94 | 0,84–1,06 |
| Edad (años) | |||
| <75 | 579/669 | 0,84 | 0,75–0,94 |
| ≥75 | 318/303 | 1,04 | 0,88–1,21 |
| Evento índice | |||
| Diuréticos iv<3 meses | 96/120 | 0,78 | 0,60–1,02 |
| Hospitalización<3 meses | 660/701 | 0,93 | 0,84–1,04 |
| Hospitalización 3–6 meses | 141/151 | 0,85 | 0,67–1,07 |
| Filtrado glomerular basal (mL/min/1,73m2) | |||
| ≤30 | 143/128 | 1,06 | 0,83–1,34 |
| >30 a ≤60 | 392/445 | 0,84 | 0,73–0,96 |
| >60 | 346/372 | 0,92 | 0,80–1,07 |
| Clase funcional NYHA basal | |||
| Clase I/II | 445/484 | 0,91 | 0,80–1,04 |
| Clase III/IV | 451/487 | 0,87 | 0,77–0,99 |
| Uso de sacubitrilo/valsartán basalmente | |||
| Sí | 134/153 | 0,88 | 0,70–1,11 |
| No | 760/818 | 0,90 | 0,81–0,99 |
| NT-proBNP basal por cuartiles (pg/mL) | |||
| Q1 (≤1556) | 128/161 | 0,78 | 0,62–0,99 |
| Q2 (1556–2816) | 165/201 | 0,73 | 0,60–0,90 |
| Q3 (2816–5314) | 213/257 | 0,82 | 0,69–0,99 |
| Q4 (>5314) | 355/302 | 1,16 | 0,99–1,35 |
| Fracción de eyección basal | |||
| <35% | 637/703 | 0,88 | 0,79–0,97 |
| ≥35% | 255/265 | 0,96 | 0,81–1,14 |
| <40% | 773/851 | 0,88 | 0,80–0,97 |
| ≥40% | 119/117 | 1,05 | 0,81–1,36 |
| Global | 897/972 | 0,90 | 0,82–0,98 |
HR: hazard ratio; IC95%: intervalo de confianza 95%; NYHA: New York Heart Association.
Adaptada de Armstrong et al.55.
Aunque el riesgo de la variable primaria aumentaba conforme más próxima había sido la hospitalización por IC y disminuía en los pacientes más crónicos, el beneficio de vericiguat se mantuvo en todos los pacientes, si bien hubo una tendencia a que este fuera mayor cuanto más tiempo había pasado desde la hospitalización (p=0,09).
Igualmente, parece que el beneficio de vericiguat en cuanto a la variable primaria y a sus dos componentes por separado fue mayor en los sujetos con NT-proBNP≤8000pg/mL (86% de la población VICTORIA). De igual forma, el beneficio de vericiguat fue independiente del tratamiento para la IC que tomase el paciente, analizados de manera aislada o en combinación. Además, el tratamiento con vericiguat no se asoció con un deterioro de la función renal, y la eficacia y seguridad fueron independientes del filtrado glomerular28,38,55–58.
En cuanto al riesgo de efectos secundarios, los eventos adversos graves fueron similares en ambos grupos. La hipotensión sintomática ocurrió en el 9,1% de los pacientes tratados con vericiguat y en el 7,9% de los pacientes del grupo placebo (p=0,12), y el síncope ocurrió en el 4% y 3,5% de los pacientes, respectivamente (p=0,30). La presión arterial sistólica descendió ligeramente en ambos brazos de tratamiento durante las primeras 16 semanas del estudio y luego volvió a los niveles basales. Se describieron más casos de anemia con vericiguat (7,6% y 5,7%, respectivamente), de los que 1,6% y 0,9% fueron considerados como efectos adversos graves55.
El estudio VITALITY se diseñó para conocer la eficacia y seguridad de vericiguat sobre la calidad de vida y la tolerancia al ejercicio en pacientes con IC y FEVI preservada. Se incluyeron a 789 pacientes con IC crónica y FE≥45%, clase funcional de la New York Heart Association II o III, con descompensación reciente en los 6 meses previos (hospitalización por IC o necesidad de diuréticos iv para IC sin hospitalización) y péptidos natriuréticos elevados.
Los pacientes fueron aleatorizados para recibir vericiguat titulado hasta 15mg (n=264) o 10mg (n=263), o a placebo (n=262). No se encontraron diferencias significativas ni en las puntuaciones de limitación física del cuestionario Kansas City, ni en la prueba de los 6 minutos entre los grupos, tras 24 semanas de tratamiento59,60.
Papel de vericiguat en el tratamiento de los pacientes con insuficiencia cardíacaLas guías europeas de IC de 2021 establecen como tratamientos de primera línea en los pacientes con IC-FEr el uso de sacubitrilo-valsartán o inhibidores de la enzima convertidora de angiotensina, betabloqueantes, antagonistas de la aldosterona e inhibidores SGLT-2. Vericiguat se encontraría en un segundo escalón en los pacientes que continuasen sintomáticos, principalmente tras una descompensación reciente24. Estas recomendaciones se basan fundamentalmente en los ensayos clínicos pivotales de estos fármacos.
Sin embargo, dado que en estos momentos no hay un ensayo clínico que compare la eficacia de los diferentes tratamientos para la IC entre sí, y solo se pueden hacer comparaciones indirectas entre estos estudios, es importante hacer un análisis crítico61,62. Comparar los resultados de los ensayos clínicos empleando únicamente la HR es claramente insuficiente, y exige una valoración global de los estudios, considerando su diseño, el perfil de riesgo de los pacientes incluidos, la duración del estudio, así como las reducciones absolutas y relativas de riesgo.
En este contexto, y considerando el diferente perfil de riesgo de los pacientes, más que comparar los HR, las diferencias absolutas de riesgo anualizadas podrían aportar una información más relevante61,62. Así por ejemplo, mientras que las reducciones relativas en los estudios PARADIGM HF, DAPA-HF y EMPEROR-Reduced fueron superiores que la obtenida en el estudio VICTORIA, las reducciones absolutas de riesgo fueron similares para vericiguat y los inhibidores SGLT-2 y superiores a las obtenidas por sacubitrilo/valsartán, considerando además que los pacientes incluidos en el estudio VICTORIA fueron los de mayor riesgo en comparación con el resto de los estudios contemporáneos para la IC. De hecho, el número necesario de pacientes a tratar para la variable primaria fue de 24 pacientes para vericiguat y de 37 pacientes para sacubitrilo/valsartán (tabla 4)55,63–65.
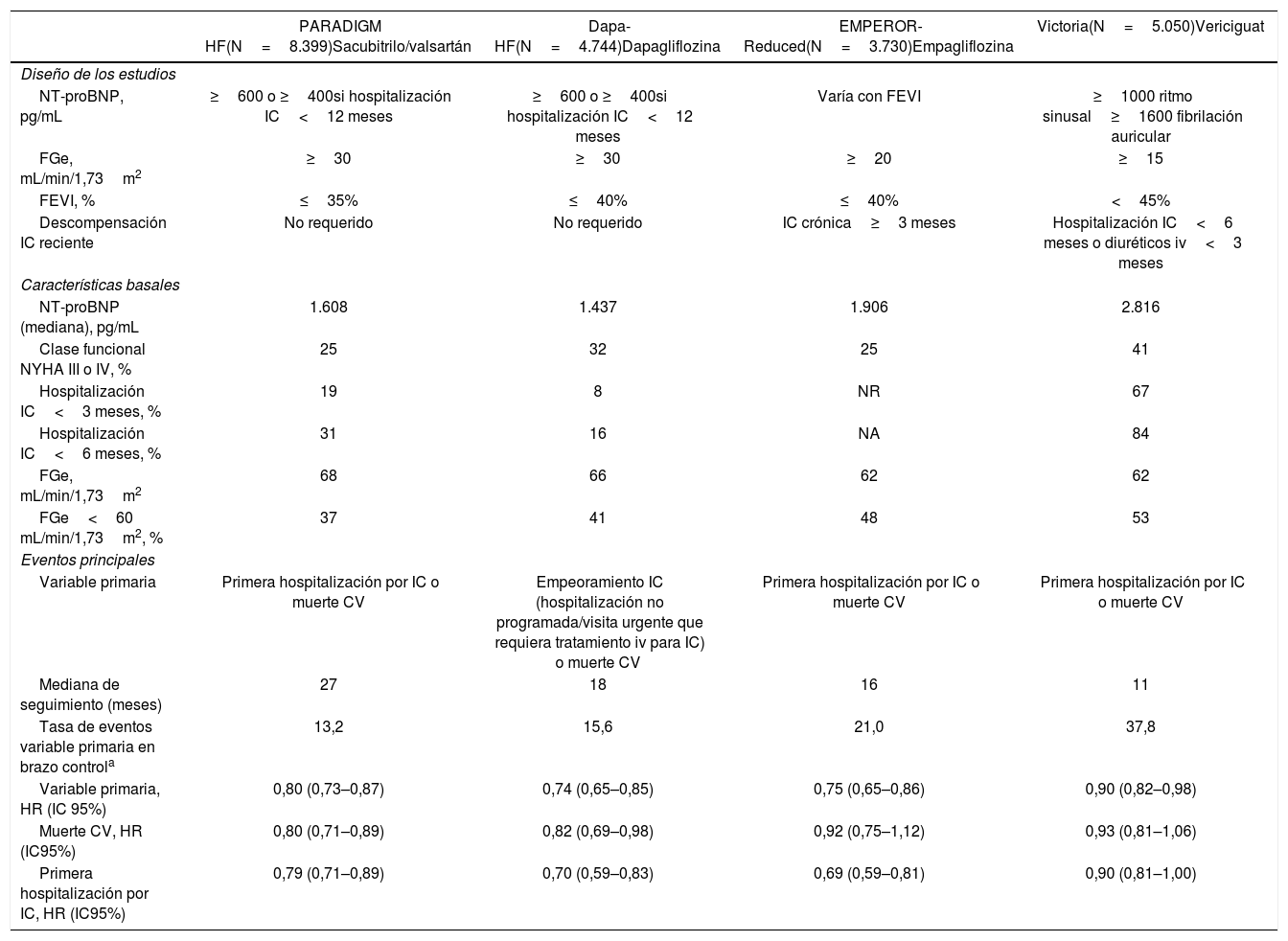
Características basales y eventos principales de los estudios PARADIGM HF, DAPA-HF, EMPEROR-Reduced y VICTORIA
| PARADIGM HF(N=8.399)Sacubitrilo/valsartán | Dapa-HF(N=4.744)Dapagliflozina | EMPEROR-Reduced(N=3.730)Empagliflozina | Victoria(N=5.050)Vericiguat | |
|---|---|---|---|---|
| Diseño de los estudios | ||||
| NT-proBNP, pg/mL | ≥600 o ≥400si hospitalización IC<12 meses | ≥600 o ≥400si hospitalización IC<12 meses | Varía con FEVI | ≥1000 ritmo sinusal≥1600 fibrilación auricular |
| FGe, mL/min/1,73m2 | ≥30 | ≥30 | ≥20 | ≥15 |
| FEVI, % | ≤35% | ≤40% | ≤40% | <45% |
| Descompensación IC reciente | No requerido | No requerido | IC crónica≥3 meses | Hospitalización IC<6 meses o diuréticos iv<3 meses |
| Características basales | ||||
| NT-proBNP (mediana), pg/mL | 1.608 | 1.437 | 1.906 | 2.816 |
| Clase funcional NYHA III o IV, % | 25 | 32 | 25 | 41 |
| Hospitalización IC<3 meses, % | 19 | 8 | NR | 67 |
| Hospitalización IC<6 meses, % | 31 | 16 | NA | 84 |
| FGe, mL/min/1,73m2 | 68 | 66 | 62 | 62 |
| FGe<60 mL/min/1,73m2, % | 37 | 41 | 48 | 53 |
| Eventos principales | ||||
| Variable primaria | Primera hospitalización por IC o muerte CV | Empeoramiento IC (hospitalización no programada/visita urgente que requiera tratamiento iv para IC) o muerte CV | Primera hospitalización por IC o muerte CV | Primera hospitalización por IC o muerte CV |
| Mediana de seguimiento (meses) | 27 | 18 | 16 | 11 |
| Tasa de eventos variable primaria en brazo controla | 13,2 | 15,6 | 21,0 | 37,8 |
| Variable primaria, HR (IC 95%) | 0,80 (0,73–0,87) | 0,74 (0,65–0,85) | 0,75 (0,65–0,86) | 0,90 (0,82–0,98) |
| Muerte CV, HR (IC95%) | 0,80 (0,71–0,89) | 0,82 (0,69–0,98) | 0,92 (0,75–1,12) | 0,93 (0,81–1,06) |
| Primera hospitalización por IC, HR (IC95%) | 0,79 (0,71–0,89) | 0,70 (0,59–0,83) | 0,69 (0,59–0,81) | 0,90 (0,81–1,00) |
| Control | Sac/vals | Control | Dapagliflozina | Control | Empagliflozina | Control | Vericiguat | |
|---|---|---|---|---|---|---|---|---|
| Variable primaria*a | 13,2 | 10,5 | 15,6 | 11,6 | 21,0 | 15,8 | 37,8 | 33,6 |
| RAR/NNT | 2,7 | 37,0 | 4,0 | 25,0 | 5,2 | 19,2 | 4,2 | 23,8 |
| Muerte CVa | 7,5 | 6,0 | 7,9 | 6,5 | 8,1 | 7,6 | 13,9 | 12,9 |
| RAR/NNT | 1,5 | 66,7 | 1,4 | 71,4 | 0,6 | 166,7 | 1,0 | 100 |
| Primera hospitalización ICa | 7,7 | 6,2 | 9,8 | 6,9 | 15,5 | 10,7 | 29,1 | 25,9 |
| RAR/NNT | 1,6 | 62,5 | 2,9 | 34,5 | 4,8 | 20,8 | 3,2 | 31,2 |
CV: cardiovascular; FEVI: fracción de eyección del ventrículo izquierdo; FGe: filtrado glomerular estimado; HR: hazard ratio; IC: insuficiencia cardíaca; IC95%: intervalo de confianza 95%; NA: no aplicable; NNT: número necesario de pacientes a tratar; NR: no reportado; NT-proBNP: propéptido natriurético cerebral N-terminal; NYHA: New York Heart Association; RAR: reducción absoluta de riesgo; sac/vals: sacubitrilo/valsartán.
En consecuencia, es necesario ir más allá de las guías de práctica clínica66 y realizar un enfoque terapéutico individualizado, empleando aquellos fármacos que hayan demostrado beneficio clínico, basado en las características de cada paciente (presión arterial, frecuencia cardíaca, función renal, niveles de potasio sérico, etc.) y no solo en las diferencias relativas de ensayos clínicos diferentes67.
En cuando al modo de empleo de vericiguat, la dosis inicial recomendada es de 2,5mg de vericiguat una vez al día, duplicando la dosis aproximadamente cada 2 semanas hasta llegar a la dosis objetivo de mantenimiento de 10mg una vez al día, en función de la tolerancia del paciente. El tratamiento se asocia con una reducción discreta de la presión arterial sistólica en comparación con placebo (1-2mmHg), y no es necesario realizar una monitorización de los electrólitos.
No se recomienda iniciar vericiguat en pacientes con una presión arterial sistólica<100mmHg. En caso de hipotensión sintomática, se recomienda reducir/suspender la dosis de vericiguat, según los casos. No se esperan interacciones farmacológicas relevantes, si bien se recomienda no emplear con los inhibidores de la fosfodiesterasa 5 de manera concomitante. Antes de comenzar el tratamiento con vericiguat tras un episodio de descompensación de IC, se recomienda optimizar el estado volémico/diurético, en particular en aquellos pacientes con niveles de NT-proBNP muy elevados36.
Con respecto al empleo de vericiguat en los sujetos con IC-FE preservada, los resultados son todavía limitados, y por lo tanto se necesitan más estudios para posicionar adecuadamente este fármaco en esta entidad.
DiscusiónA pesar de las mejoras obtenidas en los últimos años con los tratamientos actuales, el paciente con IC y, especialmente, aquellos que han tenido una descompensación reciente, todavía presentan un riesgo elevado de hospitalización por IC y de muerte durante el seguimiento7–9. Aunque el paciente mantenga cierta «estabilidad» clínica durante algún tiempo, la IC-FEr sigue progresando por la estimulación mantenida de las vías deletéreas y la supresión de las vías protectoras15,16.
En consecuencia, el tratamiento de algunas de estas vías, pero no de todas, supone un tratamiento parcial e insuficiente, que no impide la progresión de la enfermedad. Por lo tanto, el foco del tratamiento de la IC se debe basar tanto en estimular las vías protectoras como en inhibir las vías deletéreas. Y en este sentido, las guías de práctica clínica coinciden en la necesidad del tratamiento precoz con aquellos fármacos que hayan demostrado beneficio pronóstico24–26.
Vericiguat, como agonista de GCs, es capaz de estimular la vía protectora del óxido nítrico-GMPc39–44. El estudio VICTORIA se enfocó en una población diferente a la incluida en los ensayos clínicos contemporáneos de la IC, incluyendo sujetos con un mayor riesgo basal, como son los pacientes con IC con FEVI<45%, y una descompensación reciente de IC (hospitalización en los 6 meses anteriores o intensificación con diuréticos iv en los 3 meses previos)55. Por lo tanto, este estudio va en línea con las actuales guías de práctica clínica, ya que da respuesta a aquellos pacientes que persisten sintomáticos a pesar del tratamiento inicial de la IC.
En el estudio VICTORIA, cerca del 90% de los pacientes lograron la dosis objetivo de 10mg de vericiguat, lo que indica que es un fármaco muy bien tolerado. En este ensayo clínico, en el que los pacientes tomaban el tratamiento médico óptimo para la IC recomendado por las guías de práctica clínica, el tratamiento con vericiguat se tradujo en una reducción significativa del 10% del objetivo primario compuesto por muerte de causa cardiovascular o primera hospitalización por IC, con un NNT de 24.
Además, hay una rápida separación de las curvas de eventos a los 4 meses que se mantiene hasta el final del seguimiento, e incluso se observa una amplificación del beneficio55. En consecuencia, es un tratamiento cuyo beneficio va a aumentar si se inicia de manera precoz en los pacientes con IC-FEr y se mantiene en el tiempo. Un reciente metaanálisis sobre la eficacia de los estimuladores GCs confirma este beneficio sobre los eventos cardiovasculares, con un buen perfil de seguridad68.
Asimismo, el beneficio de vericiguat es independiente del tratamiento concomitante para la IC, incluyendo sacubitrilo/valsartán, así como del tiempo desde la hospitalización o episodio de descompensación de IC55. Esto implica que vericiguat se puede emplear independientemente del tratamiento de base que lleve el paciente, y que se puede prescribir en pacientes con episodio previo de hospitalización, de descompensación reciente o de necesidad de intensificación de tratamiento, así como en la consulta temprana tras el alta hospitalaria.
Por lo tanto, vericiguat permite optimizar el tratamiento cuanto antes para obtener el máximo beneficio. Además, es un fármaco particularmente favorable en los pacientes con enfermedad renal crónica (en el estudio VICTORIA se incluyeron a pacientes con filtrado glomerular≥15mL/min/1,73m2), dado que vericiguat no produce alteraciones ni de la función renal ni trastornos hidroelectrolíticos. También cabe destacar que la eficacia y seguridad del fármaco son independientes de la función renal36,55. Ahora bien, dado que el máximo beneficio de vericiguat se obtenía en pacientes con niveles de NT-proBNP≤8.000pg/mL55, es posible que haya que intensificar el tratamiento deplectivo antes de comenzar el tratamiento con vericiguat en aquellos sujetos con cifras de péptidos natriuréticos superiores a estos niveles.
Vericiguat tiene un excelente perfil de seguridad y el hecho de que no sea necesario determinar la función renal y los iones plasmáticos hacen que sea un fármaco sencillo de emplear y titular en la consulta diaria, incluyendo la teleconsulta, tan importante en el manejo del paciente con IC69.
Finalmente, se ha estimado que el empleo de vericiguat en la práctica clínica sería coste-efectivo, ya que vericiguat produce una reducción significativa de las hospitalizaciones por IC (primer episodio y recurrencias)70, que son el principal condicionante para el aumento de los costes sanitarios asociados a la IC14.
En definitiva, vericiguat se ha mostrado como un tratamiento eficaz y seguro en una población que presenta un número muy elevado de eventos en un corto período de tiempo, como son los pacientes con IC-FEr y una descompensación reciente por IC, en los que es necesario un tratamiento precoz, transversal e integral. Su sencillez en el manejo y titulación facilitarían su uso en la práctica clínica habitual.
Con respecto a los pacientes con IC-FE preservada, los resultados con vericiguat, al igual que con otros estimuladores de la GCs son discretos, por lo que en el momento actual no se puede recomendar en esta entidad53,54,60,71,72.
FinanciaciónLos autores no han recibido financiación para la elaboración de este manuscrito.
Conflicto de interesesJ.R. González-Juanatey reporta honorarios por conferencias y consejo asesor de Bayer.
M. Anguita-Sánchez ha recibido financiación por servicios de consultoría y conferencias de Bayer, Daiichi- Sankyo y Pfizer.
A. Bayes-Genís ha recibido financiación por servicios de consultoría y conferencias de AstraZeneca, Abbott, Boehringer-Ingelheim, Lilly, Novartis, Vifor, Roche Diagnostics.
J. Comín-Colet reporta honorarios por conferencias y consejo asesor de Bayer.
A. García-Quintana ha recibido financiación por servicios de consultoría y conferencias de Bayer, Daiichi-Sankyo, Pfizer, Astra Zeneca, Boerhinger Ingelheim, Novartis y Rovi.
A. Recio-Mayoral ha recibido financiación por servicios de consultoría y conferencias de Bayer, Janssen, MSD, Novartis y Vifor.
J.L. Zamorano-Gómez reporta honorarios por conferencias de Bayer.
J.M. Cepeda ha recibido honorarios por servicios de consultoría y / o conferencias de Bayer, Daiichi-Sankyo y BMS-Pfizer.
L. Manzano ha recibido retribuciones por servicios de consultoría y conferencias de Bayer, Daiichi-Sankyo y BMS-Pfizer.
AgradecimientosContent Ed Net (Madrid, España) proporcionó asistencia en la redacción y la edición con financiación de Bayer Hispania.