Los pacientes con diabetes mellitus (DM) e insuficiencia cardiaca (IC) presentan peor pronóstico a pesar de los avances terapéuticos en ambas enfermedades. Los inhibidores del cotransportador sodio-glucosa tipo 2 y agonistas del receptor de GLP-1 han demostrado beneficios cardiovasculares y se han posicionado como primer escalón en el tratamiento de DM en pacientes con IC o elevado riesgo cardiovascular. Sin embargo, en los ensayos pivotales la mayoría de los pacientes recibe tratamiento concomitante con metformina. Todavía no se han desarrollado ensayos clínicos aleatorizados para evaluar el impacto pronóstico de la metformina a nivel cardiovascular. Nuestro objetivo fue analizar si los pacientes con DM e IC aguda que recibían tratamiento con metformina en el momento del alta podrían presentar mejor pronóstico al año de seguimiento.
MétodosEnsayo de cohortes prospectivo mediante el análisis combinado de los 2 principales registros españoles de IC: el Registro Epidemiology of Acute Heart Failure in Emergency Departments –EAHFE– y el Registro Nacional de Pacientes con Insuficiencia Cardiaca –RICA–.
ResultadosDe un total de 4.403 pacientes con DM tipo 2, recibió tratamiento con metformina el 33% (1.453). Este grupo presentó una mortalidad significativamente inferior al año de tratamiento (22 versus 32%; test de Log Rank p<0,001). En el análisis ajustado de mortalidad, los pacientes que recibieron tratamiento con metformina presentaron menor mortalidad al año de seguimiento independientemente del resto de las variables (RR 0,814; IC 95% 0,712-0,930; p<0,01).
ConclusionesLos pacientes con DM tipo 2 e IC aguda que recibieron metformina presentaron mejor pronóstico al año de seguimiento, por lo que consideramos que este fármaco debe continuar siendo un pilar fundamental en el tratamiento de estos pacientes.
Patients with diabetes mellitus (DM) and heart failure (HF) have a worse prognosis despite therapeutic advances in both diseases. Sodium-glucose co-transporter type 2 and GLP-1 receptor agonists have shown cardiovascular benefits and have been positioned as the first step in the treatment of DM in patients with HF or high cardiovascular risk. However, in the pivotal trials the majority of patients receives concomitant treatment with metformin. Randomized clinical trials have not yet been developed to assess the prognostic impact of metformin at the cardiovascular level. Our objective was to analyze whether patients with DM and acute HF who receive treatment with metformin at the time of discharge may have had a better prognosis at one year of follow-up.
MethodsProspective cohort trial using the combined analysis of the 2 main Spanish HF registries: the Epidemiology of Acute Heart Failure in Emergency Departments registry –EAHFE– and the National Registry of Patients with Heart Failure –RICA–.
Results33% (1453) of a total of 4403 patients with DM type 2 received treatment with metformin. This group presented significantly lower mortality after one year of treatment (22 vs. 32%; Log Rank test, p<0.001). In the adjusted analysis of mortality, patients receiving treatment with metformin had lower mortality at one year of follow-up regardless of the rest of the variables (RR 0.814; 95% CI: 0.712–0.930; p<0.01).
ConclusionsPatients with DM type 2 and acute HF who received metformin had a better prognosis after one year of follow-up, so we believe that this drug should continue to be a fundamental pillar in the treatment of these patients.
La prevalencia e incidencia de la insuficiencia cardiaca (IC) y la diabetes mellitus (DM) han aumentado de forma progresiva en la última década1,2. La DM tipo 2 se considera un factor independiente para el desarrollo de IC3 y, a su vez, se asocia a un peor pronóstico en IC4,5. En los pacientes hospitalizados por IC, la DM se asocia con mayor estancia hospitalaria y tasa de reingreso6,7, así como con mayor comorbilidad asociada7,8. Sin embargo, el papel de la DM en la mortalidad hospitalaria y a largo plazo en pacientes con IC continúa siendo controvertido9,10. Los datos del Registro Nacional de Pacientes con Insuficiencia Cardiaca (RICA) revelan que los pacientes con DM tipo 2 presentan mayor tasa de reingresos por IC y mortalidad a largo plazo frente a los que no padecen esta enfermedad, si bien la mortalidad intrahospitalaria parece igualarse en ambos grupos4.
El tratamiento neurohormonal disponible en los últimos años ha mejorado el pronóstico de los pacientes con IC11, y 2 grupos de fármacos hipoglucemiantes, los inhibidores del cotransportador sodio-glucosa tipo 2 (iSGLT2) y los agonistas del receptor de GLP-1 (arGLP-1) han demostrado beneficios a nivel cardiovascular tanto en pacientes con DM tipo 2 como en los que no la presentan12–27. La última guía europea de DM28 recomienda estos fármacos como tratamiento de inicio en los pacientes de riesgo cardiovascular alto o muy alto y que no estén recibiendo todavía metformina.
La metformina es un fármaco clásico dentro del tratamiento de la DM tipo 229,30. Por su evidencia en el descenso en las complicaciones macrovasculares31, las guías lo recomiendan como primera opción de tratamiento en la mayoría de los pacientes. Sin embargo, su efecto en el pronóstico de los pacientes con IC todavía no ha sido investigado. El objetivo principal de este estudio fue analizar si los pacientes con DM e IC aguda que reciben tratamiento con metformina en el momento del alta presentan mejor pronóstico al año de seguimiento.
Material y métodosDiseño y fuente de los datosPlanteamos un estudio observacional de cohortes prospectivo en el que combinamos datos de pacientes incluidos en los 2 principales registros españoles de IC: el registro Epidemiology of Acute Heart Failure in Emergency Departments (EAHFE) y el RICA. Se trata de un estudio de efectividad que pretende valorar en una población real el uso de la metformina y su impacto pronóstico al año de seguimiento.
El registro EAHFE es un estudio de cohorte multicéntrico, de carácter analítico no intervencionista con seguimiento prospectivo32–34, promovido por el Grupo de Trabajo de Insuficiencia Cardiaca de la Sociedad Española de Medicina de Urgencias y Emergencias. Participan un total de 45 servicios de urgencias hospitalarios (SUH) españoles, que han incorporado 18.370 pacientes diagnosticados de IC aguda entre 2007 y 2018, en 6 periodos de selección de 1-2 meses cada 2 o 3 años. Este registro no incluye ninguna intervención planificada ni modifica la atención recibida por el médico asistencial, la cual está basada en las guías de práctica clínica (GPC) y los protocolos de cada centro hospitalario.
El RICA es un estudio de cohorte prospectivo multicéntrico35,36 del Grupo de Trabajo Insuficiencia Cardiaca y Fibrilación Auricular de la Sociedad Española de Medicina Interna. Participan 52 centros públicos y privados de España y está activo desde 2008. En él se incluyen pacientes únicos consecutivos, mayores de 50 años, con diagnóstico de IC al alta hospitalaria tras un episodio de descompensación de IC de nueva aparición, de acuerdo con la definición de las guías de la Sociedad Europea de Cardiología vigentes37.
Población de estudioSe incluyeron todos los pacientes del RICA hasta el año 2018 y las poblaciones de EAHFE-5 (periodo de inclusión del 1 de enero al 29 de febrero de 2016, con participación de 30 SUH) y EAHFE-6 (periodo de inclusión del 1 de febrero al 31 de marzo de 2018, con participación de 34 SUH), en las cuales se recogieron datos relacionados con el tratamiento de la DM. Tras realizar los trámites pertinentes en cuanto a permisos de manejo de datos para ambos registros, se realizó una base de datos conjunta manteniendo todas las variables comunes y eliminando las no coincidentes, para favorecer el análisis unificado de ambas poblaciones de estudio. Dentro de este grupo poblacional seleccionamos como población a estudio los pacientes con DM tipo 2 (si constaba como diagnóstico previo, tomaban fármacos hipoglucemiantes o si su concentración de hemoglobina glucosilada al ingreso era>6,5%).
VariablesSe recogieron variables clínicas y de tratamiento que han sido definidas en otros artículos previos del RICA4 y el EAHFE38. Se realizó un seguimiento a 12 meses desde el alta hospitalaria del episodio índice de IC aguda, y se registró la mortalidad al año por cualquier causa mediante consulta de la historia clínica o contacto directo, y en caso necesario se verificó en el registro de la Seguridad Social, donde los pacientes fallecidos constan baja al día siguiente del deceso. Se excluyeron del estudio los pacientes que fallecieron en el hospital durante el episodio índice. Para calcular la variable de tiempo de seguimiento, se dispone de la fecha de finalización del estudio (correspondiente al año de seguimiento desde el episodio índice), la fecha de exitus o la fecha de pérdida de seguimiento en aquellos casos en que ocurrió la pérdida de seguimiento antes del año (fecha de censura para el estudio de supervivencia).
Consideraciones éticasEl protocolo del RICA fue aprobado por el Comité de Ética del Hospital Universitario Reina Sofía de Córdoba (España) y el del registro EAHFE por el del Hospital Universitario Central de Asturias (Oviedo, España). Los números de referencia para las fases 5 y 6 son 160/15 y 205/17, respectivamente. Los datos fueron introducidos en bases de datos anonimizadas y han sido manejados de acuerdo con el RD 1720/2007 que desarrolla la Ley Orgánica 15/1999, de 13 de diciembre, de Protección de Datos de Carácter Personal4,35,36. El estudio se llevó a cabo en estricto cumplimiento de los principios éticos de la Declaración de Helsinki. Al tratarse de estudios observacionales de cohortes, ambos registros siguieron las pautas STROBE para este método.
Análisis estadísticoLas variables cualitativas han sido expresadas como frecuencia y porcentaje. Las variables cuantitativas continuas se muestran como media y desviación estándar tras realizar la prueba de análisis de normalidad de Kolmogorov-Smirnov. El análisis comparativo bivariante se realizó mediante la prueba de ji cuadrado cuando eran 2 pruebas catégoricas, y mediante ANOVA para la comparación de variables cuantitativas de más de 2 grupos. Para el análisis de mortalidad se realizaron las curvas de supervivencia de Kaplan-Meier y el test de Log Rank. Se ha llevado a cabo un análisis multivariante de riesgos proporcionales de regresión de Cox por el método hacia atrás condicional para las variables que en el análisis univariante mostraban una relación significativamente estadística con la probabilidad de muerte. El riesgo asociado a fallecer por cualquier causa en los pacientes en tratamiento se expresó como riesgo relativo (RR) con su intervalo de confianza del 95% (IC 95%) respecto a los pacientes que no recibían metformina. Se ha realizado un forest plot para valorar cómo se comporta la metformina en diferentes subpoblaciones de pacientes. Todos los análisis estadísticos se realizaron con SPSS® 26.0 (IBM, Chicago, IL, EE. UU.). La significación estadística se estableció como p<0,05 o si el IC 95% de la hazard ratio no incluía el valor 1.
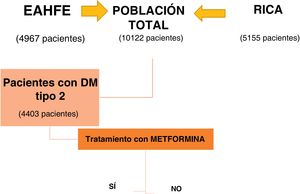
ResultadosDel total de 10.122 pacientes incluidos al aunar las bases de datos EAHFE y RICA, se incluyeron 4.403 pacientes con DM tipo 2, lo que supone el 43,5% del total. El análisis de subgrupos se realizó en función de si recibían o no tratamiento con metformina al alta del episodio índice de descompensación (fig. 1).
En la tabla 1 se describen las características del grupo de pacientes con DM tipo 2 y de ambos subgrupos. Los 1.453 pacientes que reciben tratamiento con metformina tras el alta hospitalaria representan un 33% del total de los pacientes con DM tipo 2. Estos pacientes son más jóvenes (77 versus 79 años; p<0,001) y presentan menor comorbilidad, siendo significativamente inferior la prevalencia de cardiopatía isquémica (29 versus 34%; p<0,011) y enfermedad renal crónica (24 versus 50%; p<0,01). Además, presentan mejor situación funcional, con menor porcentaje de clase funcional NYHA III-IV (35 versus 29%; p<0,001) y mayor puntuación en el índice de Barthel (84 versus 79; p<0,01). Los fármacos que reciben ambos grupos respecto al tratamiento de IC están expuestos en la tabla y respecto al tratamiento de DM, el grupo de metformina presenta con mayor frecuencia otros antidiabéticos orales asociados y menor porcentaje de insulinización (tabla 1).
Descripción de las características de los pacientes con DM tipo 2 y comparación de los pacientes con DM tipo 2 en función de si recibían o no tratamiento con metformina
| Pacientes con DM tipo 2 en tratamiento con metformina | ||||
|---|---|---|---|---|
| Total de pacientes con DM tipo 2 | No | Sí | ||
| N=4.403 | n=2.950 | n=1.453 | p | |
| n (%) | n (%) | n (%) | ||
| Registro | ||||
| EAHFE | 2.019 (45,9) | 1.408 (69,7) | 611 (30,3) | <0,001 |
| RICA | 2.384 (54,1) | 1.542 (64,6) | 842 (35,3) | |
| Datos demográficos | ||||
| Edada | 79,26 (8,99) | 79,87 (8,88) | 77,85 (9,17) | <0,001 |
| Sexo varón | 2.087 (47,4) | 1.395 (47,3) | 692 (47,7) | 0,825 |
| Sexo femenino | 2.314 (52,6) | 1.554 (52,7) | 760 (52,3) | |
| Comorbilidades | ||||
| HTA | 4.034 (91,6) | 2.710 (91,9) | 1.324 (91,1) | 0,403 |
| Dislipidemia | 2.776 (63) | 1.825 (61,9) | 951 (65,5) | 0,02 |
| Cardiopatía isquémica | 1.425 (32,4) | 1.003 (34) | 422 (29) | <0,001 |
| Enfermedad renal crónica | 1.834 (41,7) | 1.479 (50,1) | 355 (24,4) | <0,001 |
| Enfermedad cerebrovascular | 614 (13,9) | 408 (13,8) | 206 (14,2) | 0,755 |
| Fibrilación auricular | 2.164 (49,1) | 1.467 (49,7) | 697 (48) | 0,272 |
| Arteriopatía | 594 (13,5) | 417 (14,1) | 177 (12,2) | 0,076 |
| Valvulopatía | 350 (20) | 221 (14,3) | 129 (15,3) | 0,514 |
| EPOC | 1.015 (23,1) | 691 (23,4) | 324 (22,3) | 0,411 |
| Demencia | 288 (6,5) | 205 (6,9) | 83 (5,7) | 0,12 |
| Neoplasia activa | 548 (12,5) | 378 (12,8) | 170 (11,7) | 0,294 |
| Cirrosis | 75 (1,7) | 58 (2) | 17 (1,2) | 0,055 |
| Estado basal | ||||
| Clase funcional medida con la escala NYHA | ||||
| Clase funcional NYHA | <0,001 | |||
| NYHA I | 579 (13,2) | 346 (11,7) | 233 (16) | |
| NYHA II | 2.355 (53,5) | 1.557 (52,8) | 798 (54,9) | |
| NYHA III | 1.382 (31,4) | 991 (33,6) | 391 (26,9) | |
| NYHA IV | 87 (2) | 56 (1,9) | 31 (2,1) | |
| NYHA III-IV | 1.469 (33,4) | 1.047 (35,5) | 422 (29) | <0,001 |
| FEVI | ||||
| FEVIa | 51,9 (14,7) | |||
| Índice de Barthel | ||||
| Índice de Barthela | 81,29 (22,6) | 79,61 (23,3) | 84,84 (0,5) | <0,001 |
| Tratamiento diurético | ||||
| Diuréticos de asa | 3.209 (72,9) | 2.118 (71,8) | 1.091 (75,1) | 0,019 |
| Fármacos modificadores de la enfermedad | ||||
| IECA | 1.447 (32,9) | 871 (29,5) | 576 (39,7) | <0,001 |
| ARA-II | 1.175 (26,7) | 721 (24,4) | 454 (31,3) | <0,001 |
| ARNI (sacubitrilo-valsartán) | 68 (1,5) | 42 (1,4) | 26 (1,8) | 0,353 |
| Betabloqueantes | 2.666 (60,6) | 1.674 (56,8) | 992 (68,3) | <0,001 |
| Antagonistas del receptor de aldosterona | 855 (19,4) | 566 (19,2) | 289 (19,9) | 0,572 |
| Ivabradina | 72 (1,6) | 49 (1,7) | 23 (1,6) | 0,85 |
| Otros fármacos | ||||
| Antagonistas del calcio | 1.205 (27,4) | 798 (27,1) | 407 (28) | 0,493 |
| Digoxina | 425 (9,7) | 265 (9) | 160 (11) | 0,032 |
| Amiodarona | 138 (3,1) | 92 (3,1) | 46 (3,2) | 0,93 |
| Nitratos | 833 (18,9) | 587 (19,9) | 246 (16,9) | 0,019 |
| Hidralazina | 79 (1,8) | 68 (2,3) | 11 (0,8) | <0,001 |
| Antiagregantes | 1.431 (32,5) | 912 (30,9) | 519 (35,7) | <0,001 |
| Dicumarínicos | 1.218 (27,7) | 792 (26,8) | 425 (29,3) | 0,082 |
| ACOD | 506 (11,5) | 318 (10,8) | 188 (12,9) | 0,034 |
| Estatinas | 1.761 (40) | 1.114 (37,8) | 647 (44,6) | <0,001 |
| Tratamiento DM | ||||
| Otros ADO diferentes | 2.631 (59,8) | 1.383 (46,9) | 1.248 (86) | <0,001 |
| Insulina | 729 (16,6) | 526 (17,8) | 203 (14) | 0,001 |
| Sulfonilureas | 325 (7,4) | 178 (6) | 147 (10,1) | <0,001 |
| Acarbosa | 27 (0,3) | 19 (0,6) | 8 (0,6) | 0,711 |
| Meglitinidas | 263 (6) | 170 (5,8) | 93 (6,4) | 0,395 |
| IDPP-4 | 391 (8,9) | 235 (8) | 156 (10,8) | 0,002 |
| arGLP-1 | 21 (0,5) | 14 (0,5) | 7 (0,5) | 0,972 |
| iSGLT2 | 67 (1,5) | 27 (0,9) | 40 (2,8) | <0,001 |
| Dispositivos | ||||
| Marcapasos | 317 (7,2) | 320 (7,5) | 97 (6,7) | 0,354 |
| DAI | 59 (1,3) | 37 (1,3) | 22 (1,5) | 0,476 |
| Resincronizador | 55 (1,3) | 38 (1,3) | 17 (1,2) | 0,745 |
| Seguimiento | ||||
| Mortalidad | 1.282 (29,1) | 962 (32,6) | 320 (22) | <0,001 |
| Tiempo de seguimientoa | 367 (288,8) | 357 (286,9) | 388 (294,9) | 0,01 |
ACOD: anticoagulante de acción directa; ADO: antidiabéticos orales; ARA-II: antagonistas de los receptores de la angiotensina ii; arGLP-1: agonistas del receptor de GLP-1; ARNI: inhibidor de la neprilisina y del receptor de angiotensina; DAI: desfibrilador automático implantable; DM: diabetes mellitus; EAHFE: Epidemiology of Acute Heart Failure in Emergency Departments; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección de ventrículo izquierdo; HTA: hipertensión arterial; IDPP-4: inhibidores de la dipeptidil peptidasa-4; IECA: inhibidores de la enzima convertidora de angiotensina; iSGLT2: inhibidores del cotransportador sodio-glucosa tipo 2; NYHA: New York Heart Association; RICA: Registro Nacional de Pacientes con Insuficiencia Cardiaca.
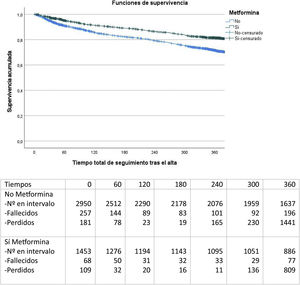
En el seguimiento a 12 meses (fig. 2), se observa que el grupo de pacientes con metformina al alta presenta una mortalidad significativamente inferior (22 versus 32%; test de Log Rank, p<0,001).
Se realiza análisis univariante y multivariante respecto a la mortalidad al año de seguimiento (tabla 2). En el análisis ajustado, los pacientes que presentan mayor mortalidad al año de seguimiento tienen mayor edad (RR 1,025; IC 95% 1,018-1,033; p<0,001) y presentan con mayor frecuencia comorbilidad asociada, como cardiopatía isquémica (RR 1,155; IC 95% 1,020-1,307; p=0,023) o enfermedad renal crónica (RR 1,360; IC 95% 1,210-1,529; p<0,001), así como peor clase funcional (clase funcional NYHA III-IV) (RR 1,280; IC 95% 1,139-1,438; p<0,001). En este análisis el tratamiento con IECA (RR 0,839; IC 95% 0,736-0,956; p<0,01), ARA-II (RR 0,766; IC 95% 0,668-0,878; p<0,001), betabloqueantes (RR 0,822; IC 95% 0,731-0,925; p<0,01) y metformina son factores protectores.
Análisis univariante y multivariante análisis de regresión de Cox para mortalidad al año
| Variable | Análisis univariante | Análisis multivariante | ||
|---|---|---|---|---|
| RR (IC 95%) | p | RR (IC 95%) | p | |
| Metformina | 0,811 (0,704-0,934) | <0,001 | 0,814 (0,712-0,930) | <0,01 |
| Edad | 1,025 (1,018-1,033) | <0,001 | 1,026 (1,018-1,033) | <0,001 |
| Dislipidemia | 0,949 (0,840-1,073) | 0,404 | NS | |
| Cardiopatía isquémica | 1,172 (1,029-1,334) | 0,017 | 1,155 (1,020-1,307) | 0,023 |
| Enfermedad renal crónica | 1,372 (1,219-1,545) | <0,001 | 1,360 (1,210-1,529) | <0,001 |
| Clase funcional NYHA III-IV | 1,267 (1,127-1,424) | <0,001 | 1,280 (1,139-1,438) | <0,001 |
| Índice de Barthel | 0,988 (0,986-0,990) | <0,001 | 0,988 (0,986-0,990) | <0,001 |
| Diuréticos de asa | 1,218 (1,066-1,391) | 0,005 | 1,231 (1,081-1,403) | <0,01 |
| IECA | 0,832 (0,729-0,950) | 0,007 | 0,839 (0,736-0,956) | <0,01 |
| ARA-II | 0,761 (0,662-0,875) | <0,001 | 0,766 (0,668-0,878) | <0,001 |
| Betabloqueantes | 0,824 (0,731-0,929) | 0,002 | 0,822 (0,731-0,925) | <0,01 |
| Digoxina | 1,146 (0,962-1,365) | 0,126 | NS | |
| Nitratos | 1,172 (1,017-1,350) | 0,028 | 1,183 (1,030-1,358) | <0,05 |
| Hidralazina | 0,943 (0,633-1,406) | 0,774 | NS | |
| Antiagregantes | 1,039 (0,913-1,183) | 0,558 | NS | |
| Anticoagulantes directos | 0,909 (0,753-1,097) | 0,321 | NS | |
| Estatinas | 0,917 (0,807-1,043) | 0,186 | NS | |
| ADO | 1,048 (0,918-1,196) | 0,487 | NS | |
| Insulina | 1,066 (0,908-1,251) | 0,443 | NS | |
| Sulfonilureas | 0,802 (0,634-1,016) | 0,067 | NS | |
| DPP4-i | 1,036 (0,852-1,260) | 0,724 | NS | |
| iSGLT2 | 0,718 (0,384-1,333) | 0,300 | NS | |
ADO: antidiabéticos orales; ARA-II: antagonistas de los receptores de la angiotensina ii; IC 95%: intervalo de confianza del 95%; IDPP-4: inhibidores de la dipeptidil peptidasa-4; IECA: inhibidores de la enzima convertidora de angiotensina; iSGLT2: inhibidores del cotransportador sodio-glucosa tipo 2; NS: no significativo; NYHA: New York Heart Association; RR: riesgo relativo.
En negrita, datos estadísticamente significativos.
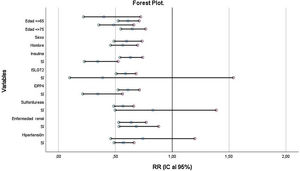
Los resultados del forest plot se presentan en la figura 2. Como puede observarse, la metformina mantiene su efecto protector para la mortalidad en la mayoría de los subgrupos, excepto para los grupos de iSGLT2, sulfonilureas y antecedentes de hipertensión arterial.
Los pacientes que reciben tratamiento con metformina presentan menor mortalidad al año de seguimiento (RR 0,814; IC 95% 0,712-0,930; p<0,01) de forma significativa, independientemente del resto de las variables (fig. 3).
DiscusiónEn primer lugar, llama la atención que se prescribió metformina al alta sólo en un tercio de los pacientes con DM, por debajo de lo esperable según las recomendaciones de las GPC. Los pacientes de los registros EAHFE y RICA son atendidos en SUH o en planta de hospitalización de medicina interna y tienen un perfil más geriátrico que la población incluida en los ensayos clínicos aleatorizados (ECA), con mayor edad, fragilidad y comorbilidades. Esta diferencia de población es una posible explicación para la infraprescripción en nuestro estudio. Otros estudios poblacionales que también han reportado un porcentaje importante de infrautilización de fármacos como la metformina, los arGLP-1 y los iSGLT239 la atribuyen al importante porcentaje de pacientes con edad avanzada de la población española, cuyas particularidades pueden limitar el uso de algunos fármacos.
Sin embargo, la infrautilización de metformina también se podría explicar por adherencia a las GPC o por miedo a los efectos adversos (EA). Este fármaco está contraindicado cuando el filtrado glomerular es<30mL/min/1,73m2 y se recomienda suspenderlo en pacientes graves con riesgo de insuficiencia renal aguda o acidosis metabólica. El temor al desarrollo de EA, en particular de acidosis láctica, es la principal causa de la tendencia a retirar este fármaco en los pacientes hospitalizados de forma sistemática e independiente de la situación clínica del paciente, a pesar de que la evidencia científica a este respecto ha evolucionado en los últimos años. En el pasado, aunque algunos estudios ya evidenciaban que esta asociación podía ser casual40, el uso de metformina en pacientes con IC descompensada o avanzada (NYHA III-IV) no estaba recomendado en las GPC. Posteriormente se ha demostrado en registros o estudios observacionales que el riesgo de esta complicación es independiente de la toma de metformina41,42. En la última GPC de DM28 se establece que la metformina es segura en todas las fases de IC con función renal conservada o moderadamente reducida (filtrado glomerular>30mL/min/1,73m2), y tiene menor riesgo de mortalidad o ingreso por IC comparada con insulina y sulfonilureas. En dicho documento también se rechaza el riesgo de acidosis láctica en relación con este fármaco41,43,44.
Como hemos introducido previamente, la metformina demostró reducir las complicaciones cardiovasculares en DM, disminuyendo en un 30% la mortalidad total y de causa cardiovascular, en un 39% el infarto agudo de miocardio y en un 41% el accidente cerebrovascular en los primeros 10 años del diagnóstico31. Sin embargo, hasta ahora no se han desarrollado ECA para evaluar el efecto de la metformina a nivel cardiovascular. Tras los estudios pivotales de los arGLP-1 y los iSGLT2, estos fármacos se sitúan ya en las guías de DM28 como los fármacos de elección en los pacientes con DM y muy alto riesgo cardiovascular, recomendándolos incluso de inicio en algunos casos. No obstante, cuando se realizaron estos ECA la mayoría recibía tratamiento concomitante con metformina y se evaluaron sus efectos sumados a los de este fármaco. El ECA DANish con el subestudio Met-HeFT está diseñado para evaluar la eficacia y seguridad de la metformina en pacientes con IC crónica; actualmente se encuentra en fase 4 y aportará por primera vez datos sobre el riesgo de acidosis láctica en un ECA45. En espera de su publicación, la evidencia científica disponible en el momento actual ha permitido que tanto las GPC de IC11 como de DM28 recomienden el uso de la metformina en este perfil de pacientes. Los resultados de nuestro estudio refuerzan esta recomendación, ya que los pacientes con DM tipo 2 e IC en tratamiento con metformina presentaron menor mortalidad al año de seguimiento, independientemente del resto de los factores. Por tanto, consideramos que la prescripción de este fármaco en este grupo de pacientes debe continuar siendo un pilar fundamental en el tratamiento y evitar su infraprescripción por miedo a potenciales EA.
En segundo lugar, hay que señalar que en nuestro estudio el porcentaje de pacientes en tratamiento con fármacos del grupo arGLP-1 e iSGLT-2 es muy reducido, debido a que la inclusión de pacientes finalizó en 2018, antes de la generalización de su uso en este perfil de pacientes. Aunque el grupo de pacientes con DM tipo 2 en tratamiento con metformina de nuestro estudio tenía un mayor porcentaje de asociación con iSGLT-2 que el grupo sin metformina, estos suponen 40 del total de 1.453 pacientes con DM en tratamiento con metformina, por lo que no consideramos que nuestros resultados se hayan visto sesgados por la influencia de este grupo farmacológico. Consideramos que será interesante realizar este análisis de nuevo con las cohortes EAHFE y RICA posteriores a 2018, en las que presumiblemente el porcentaje de pacientes tratados con estos grupos terapéuticos será mayor.
Este estudio tiene varias limitaciones. En primer lugar, al tratarse de un análisis retrospectivo, los resultados son correlaciones y no implican causalidad, lo que nos permite únicamente formular hipótesis. En segundo lugar, puede existir un sesgo de selección al proceder los pacientes de centros adheridos voluntariamente y por ser el periodo de estudio muy amplio. La tercera limitación está relacionada con la gran variabilidad, tanto estructural como de gestión, de los centros participantes; en este sentido, es conocida la considerable heterogeneidad de las estrategias de control y seguimiento de la IC en España46,47. En cuarto lugar, el diagnóstico de los pacientes se estableció por criterio clínico, y aunque en la mayoría de los casos se confirmó con péptidos natriuréticos o ecocardiografía, todavía existe la posibilidad de un error diagnóstico. En quinto lugar, la asignación de los pacientes a los grupos con y sin tratamiento con metformina se hizo con base en la prescripción en el momento del alta, pero este aspecto no se monitorizó durante el seguimiento, por lo que puede haber pacientes que hubiesen cambiado de grupo. No obstante, dada la experiencia que se tiene con este fármaco, creemos que el porcentaje de pacientes que pudieran haber cambiado de grupo ha sido bajo. Sexta, aunque en los modelos ajustados se tuvo en cuenta el grado de dependencia del paciente (medido a través del índice de Barthel), no se ha tenido en cuenta la fragilidad, y este es un aspecto con un importante impacto en los pacientes mayores y específicamente en los afectados de IC48,49. Por último, se trata de un análisis en el cual no se ha realizado estimación del tamaño muestral, por lo que es posible que se haya incurrido en error estadístico de tipo beta en algunas de las estimaciones. Sin embargo, dado que nuestros resultados se basan en la información obtenida de los 2 principales registros multicéntricos de pacientes con IC de España, consideramos que son representativos y potencialmente extrapolables al conjunto de la población española.
Como conclusión, en nuestro estudio, los pacientes con DM e IC que reciben tratamiento con metformina presentan menor mortalidad al año de seguimiento. Por tanto, consideramos que la prescripción de este fármaco en este perfil de pacientes debe continuar siendo un pilar fundamental en el tratamiento y evitar su infraprescripción por miedo a potenciales EA.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.