La actual crisis sanitaria producida por el SARS-CoV-2 y las consecuencias, en ocasiones fatales, de la tormenta de citoquinas asociada al mismo han conducido a emplear terapias destinadas a frenar la hiperactivación del sistema inmune. Dentro de ellas, los corticoides se han convertido en uno de los tratamientos de elección cuando la evolución clínica y analítica no es favorable.
Como todo régimen inmunosupresor, los corticoides no están exentos de riesgos, y lo ideal sería poder prevenirlos. La reactivación de infecciones adquiridas previamente sería uno de ellos, siendo de especial interés la hepatitis B, tanto por su frecuencia como por la existencia de armas para frenarla. Además, en un reciente estudio se ha relacionado la infección crónica por VHB con un enlentecimiento en la eliminación del SARS-CoV-21.
En esta línea revisamos las últimas recomendaciones acerca del manejo de los pacientes candidatos a recibir corticoides a dosis elevadas o en modo de pulsos (pauta utilizada en nuestro hospital), en este caso en el tratamiento del SARS-CoV-2.
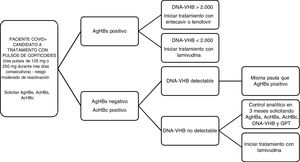
En primer lugar, la EASL2 y la AGA3 aconsejan el cribado del VHB en todos los pacientes que van a recibir tratamiento inmunosupresor a través de la determinación de HBsAg y anti-HBc. Con ello, según las recomendaciones de la AEMPS de julio de 20144, ante un HBsAg+ con carga viral superior o igual a 2.000U/ml debemos iniciar tratamiento con entecavir o tenofovir, mientras que si es inferior a 2.000U/ml y se va a realizar un tratamiento inmunosupresor durante un corto período de tiempo, realizaremos profilaxis universal con lamivudina. Por otro lado, ante HBsAg− y anti-HBc+ con carga viral detectable se adoptaría la misma pauta que ante HBsAg+ (fig. 1).
La duda surge cuando nos encontramos ante un paciente con HBsAg−/anti-HBc+ y carga viral indetectable. Se establecen 3 grupos de riesgo en función de la probabilidad de reactivación del virus: alto (>10%), moderado (1-10%) y bajo (<1%). Existen tablas que recogen el riesgo de reactivación en función del tratamiento administrado. La amplia variedad de los regímenes de tratamiento con glucocorticoides, en cuanto a dosis y tiempos pautados, hace que sea más difícil de determinar la evidencia.
La AGA incluye en el grupo de bajo riesgo a los pacientes que reciben dosis bajas (<10mg/día) o moderadas (10-20mg/día) de prednisona o equivalente. Mientras que aquellos en tratamiento con dosis elevadas de corticoides (>20mg/día) pertenecen al grupo de riesgo moderado. No se hace referencia en esta revisión a los tiempos de duración de la corticoterapia que se manejaba en documentos previos, donde se fijaba arbitrariamente 4 semanas para definir regímenes prolongados. En ningún momento se hace mención específica a los pulsos.
Recientemente el Journal of Hepatology ha publicado un estudio retrospectivo analizando el riesgo de seroreversión del HBsAg en 12.997 pacientes expuestos al menos a una dosis de corticoides sistémicos en el período entre 2001 y 20105. De ellos, 1.800 presentaban un anti-HBc+, entre los que 830 también tenían anti-HBs+, lo que constituye un factor protector. Se observa cómo, en el grupo restante de 970 pacientes anti-HBc+/anti-HBs−, el riesgo anual de presentar un brote de hepatitis es del 16,2%, independientemente del tiempo de tratamiento con corticoides. Sí se objetiva mayor riesgo en el grupo que recibe dosis de prednisona superiores a 40mg/día. Sin embargo, no se ha podido demostrar que las diferencias en la dosis o la duración de la terapia corticoidea tengan influencia en el riesgo de seroreversión (definido como el viraje de HBsAg negativo a positivo), que es del 1,8% anual en el grupo anti-HBc+/anti-HBs−. Se refuerza así lo propuesto por la AGA, pudiendo incluir en el grupo de riesgo moderado de reactivación a los pacientes sometidos a pulsos de corticoides.
Como conclusión, en este contexto de pandemia por COVID-19, los corticoides sistémicos son uno de los tratamientos de elección. En todo paciente en los que se pauten se debería realizar el cribado del VHB a través de la determinación de HBsAg y anti-HBc.
Existe evidencia para recomendar el tratamiento profiláctico con lamivudina en pacientes HBsAg−/anti-HBc+/DNA-VHB no detectable con alto riesgo de reactivación del VHB. Igualmente, su uso está desaconsejado en quienes el riesgo es bajo. ¿Y en el grupo de riesgo moderado? La profilaxis universal presenta un grado de recomendación más débil, siendo igualmente aceptada la monitorización trimestral para iniciar el tratamiento anticipado si fuera necesario.
Asimismo, sería interesante conocer el riesgo de reactivación del VHB en el contexto de tratamiento con otros fármacos inmunosupresores empleados como tocilizumab o baricitinib. Para ambos existen estudios al respecto en artritis reumatoide, pero están limitados por el número de pacientes y el uso previo o concomitante de FAME6,7.