Esta versión actualizada de las guías de osteoporosis de la Sociedad Española de Investigación en Osteoporosis y Metabolismo Mineral (SEIOMM) incorpora la información más relevante publicada en los últimos 7años, desde las guías de 2015, con estudios de imagen, como la valoración de la fractura vertebral y el análisis del índice trabecular óseo. Además, los avances terapéuticos incluyen los nuevos fármacos anabólicos, los estudios comparativos de la eficacia de los fármacos y la terapia secuencial y combinada. Por ello se actualizan también las recomendaciones de los tratamientos.
This updated version of the Spanish Society for Research in Osteoporosis and Mineral Metabolism (SEIOMM) osteoporosis guides incorporate the most relevant information published in the last 7years, since the 2015 guides, with imaging studies, such as vertebral fracture assessment and bone trabecular score analysis. In addition, therapeutic advances include new anabolic agents, comparative studies of drug efficacy, and sequential and combined therapy. Therefore, therapeutic algorithms are also updated.
Han trascurrido 7años desde que se elaboró la última versión de las Guías de Osteoporosis de la Sociedad Española de Investigación Ósea y Metabolismo Mineral (SEIOMM), de acuerdo a la metodología estándar de la medicina basada en la evidencia1. Esta actualización incorpora la información publicada desde entonces. El texto completo está disponible en el anexo 2.
MétodosUn grupo de expertos (ver anexo 1) revisó cada una de las secciones para incorporar las novedades aparecidas en los últimos años. El nuevo texto se puso a disposición de otros entes interesados (incluyendo socios de SEIOMM, asociaciones de pacientes, Agencia Española de Medicamentos y Productos Sanitarios e industrias farmacéuticas) para que pudieran hacer aportaciones al documento, que fue después analizado, de nuevo, por el grupo de expertos. Se analiza primero la osteoporosis de las mujeres posmenopáusicas y, en segundo lugar, la del varón y la inducida por glucocorticoides.
Evaluación de las pacientes en riesgo de osteoporosisFactores clínicos de riesgo de fracturaLos principales factores de riesgo se exponen en la tabla 1. Tras sufrir una primera fractura, el mayor riesgo de sufrir una nueva fractura se da en los dos años siguientes, sobre todo si la primera fractura fue vertebral2. Esto ha llevado a formular el concepto de «riesgo inminente» de fractura.
Factores de riesgo de osteoporosis
| Factores claramente asociados a osteoporosis |
| Edad avanzada |
| Sexo femenino |
| Antecedentes personales de fractura |
| Antecedentes familiares de fractura de cadera |
| Riesgo aumentado de caídas |
| Enfermedades |
| Hipogonadismo |
| Menopausia precoz, amenorrea |
| Anorexia nerviosa |
| Malabsorción |
| Artritis reumatoide |
| Diabetes (particularmente la de tipo 1) |
| Inmovilización |
| Enfermedad de Cushing |
| Tratamientos |
| Glucocorticoides |
| Inhibidores de la aromatasa |
| Agonistas de las hormonas liberadoras de gonadotropinas (y otros tratamientos de deprivación androgénica en varones) |
| Otros factores asociados con menor consistencia |
| Hiperparatiroidismo. Hipertiroidismo |
| Déficit de calcio |
| Déficit de vitamina D |
| Fármacos y tóxicos |
| Inhibidores selectivos de la recaptación de serotonina |
| Inhibidores de la bomba de protones |
| Anticonvulsivantes |
| Antirretrovirales |
| Alcohol, tabaco |
La absorciometría por rayosX (DXA), que cuantifica la densidad mineral ósea (DMO), es el procedimiento habitualmente utilizado para estimar el riesgo de fractura. Se establece el diagnóstico de osteoporosis con un índice T<−2,5 en cualquiera de las siguientes localizaciones: columna lumbar, cadera total o cuello femoral (tabla 2).
Criterios diagnósticos de osteoporosis
| Normal: DMO T ≥−1 |
| Osteopenia o densidad mineral ósea baja: DMO T <−1 y >−2,49 |
| Osteoporosis: DMO T ≤−2,5 |
| Osteoporosis grave: DMO T ≤−2,5 +fractura |
DMO: densidad mineral ósea; T (T-score o índice T): comparación con el valor de la DMO alcanzado en población joven de referencia.
En mujeres premenopáusicas y varones menores de 50años se recomienda utilizar las puntuaciones Z, considerando Z≤−2,0 como «baja densidad mineral ósea para la edad cronológica».
El índice trabecular óseo (trabecular bone score [TBS]) puede mejorar la predicción del riesgo de fractura.
En general, se recomienda realizar una DXA cuando existen factores de riesgo que se asocian fuertemente con osteoporosis o fracturas (tabla 1).
La radiografía resulta imprescindible para identificar las fracturas. En el caso de las vertebrales, su diagnóstico exige un descenso de al menos un 20-25% de altura. En algunos casos la imagen basada en la DXA (vertebral fracture assessment [VFA]) puede ser una alternativa.
Protocolo de estudio. Marcadores de recambio óseoSe debe realizar una analítica básica con hemograma y bioquímica (función renal y hepática, calcio, albúmina, fósforo, fosfatasa alcalina, tirotropina [TSH], 25-hidroxivitaminaD [25OHD], proteinograma y calciuria). Se discute la conveniencia de determinar la hormona paratiroidea (PTH) y los marcadores de recambio óseo (MRO). En pacientes jóvenes deben realizarse otros estudios para descartar causas secundarias de osteoporosis (hipercortisolismo, celiaquía, mastocitosis sistémica, etc.).
Casi siempre serán necesarias una DXA y la valoración de posibles fracturas vertebrales.
Los MRO pueden contribuir a identificar, junto a otros factores de riesgo, a las pacientes con mayor riesgo de fractura y, sobre todo, ayudan a valorar de forma precoz la respuesta al tratamiento. Los más utilizados son los telopéptidos carboxiterminales del colágeno tipoI (Serum C-telopeptide cross-link type 1 collagen [s-CTX]) y los péptidos aminoterminales del procolágeno tipoI (Procollagen type 1 N-terminal Propeptide [P1NP]).
Herramientas de predicción de riesgoPara valorar el riesgo de fracturas, ayuda la combinación de datos clínicos y DXA. Se han elaborado varios instrumentos para este fin, como el Fracture Risk Assessment Tool (FRAX), la escala del Garvan Medical Research Institute y el QFracture Index. Tienen una capacidad discriminatoria similar y son de un rendimiento solo moderado. El FRAX es el más extendido. Lamentablemente, la adaptación de este último a España ha sido inadecuada e infraestima el riesgo de fracturas osteoporóticas mayores.
Tratamientos disponibles para la osteoporosis posmenopáusicaIntervenciones no farmacológicasSe debe mantener una dieta equilibrada, con aporte de 1-1,5g/kg de proteínas, hacer ejercicio físico regularmente y evitar el tabaco y el consumo excesivo de alcohol. Los programas de prevención de caídas y los protectores de cadera pueden ser útiles en algunos casos.
Calcio y vitamina DLas pacientes tratadas con fármacos para la osteoporosis deben recibir un aporte adecuado de calcio y vitaminaD3,4 para conseguir niveles séricos de 25OHD >25-30ng/mL. La dosis de vitaminaD generalmente recomendada es de 800-1.200UI/día (o su equivalente semanal o mensual). Si se usa calcifediol, se administran 0,266microgramos cada 15-30días. La ingesta de calcio debe ser de 1.000-1.200mg/día, preferiblemente mediante la dieta, y añadiendo suplementos si esta es insuficiente.
Fármacos sin indicación en la osteoporosisNo se consideran indicados para el tratamiento de la osteoporosis la calcitonina, el ranelato de estroncio, la PTH 1-84, las isoflavonas, los fitoestrógenos y la tibolona. Las tiazidas pueden utilizarse para controlar la hipercalciuria.
Terapia estrogénicaAunque la terapia estrogénica es eficaz en la prevención de fracturas, sus posibles efectos secundarios la desaconsejan como tratamiento de la osteoporosis, salvo que se trate de una menopausia precoz o que no se disponga de otras alternativas.
Moduladores selectivos de los receptores estrogénicosLos moduladores selectivos de los receptores estrogénicos (selective estrogen receptor modulators [SERM]) aumentan la DMO en columna. El raloxifeno y el bazedoxifeno reducen el riesgo de fractura vertebral en un 40%, pero no influyen en las no vertebrales5. Su principal complicación es un aumento del riesgo de enfermedad tromboembólica venosa.
BisfosfonatosAlendronatoEl alendronato en dosis de 70mg/semana reduce las fracturas vertebrales, las no vertebrales y las de cadera en torno a un 45%, un 25-30% y un 45-55%, respectivamente6. La mayor parte de los ensayos clínicos han incluido un período de tratamiento de 3-5años. No obstante, a veces puede ser recomendable una administración más prolongada.
RisedronatoSegún metaanálisis recientes, el risedronato reduce del riesgo de todas las fracturas (vertebrales 39%, cadera 27% y no vertebrales 22%)5. Se administra en dosis de 35mg semanales o 75mg dos días consecutivos al mes. Existe una formulación semanal gastrorresistente que no precisa la administración en ayunas.
IbandronatoTiene menor eficacia que otros bisfosfonatos (BP) y no parece disminuir las fracturas no vertebrales.
ZoledronatoEl zoledronato en dosis de 5mg/año por vía intravenosa disminuye las fracturas vertebrales, las no vertebrales y las de cadera en un 70%, un 25% y un 40%, respectivamente7. Un metaanálisis en red no encontró diferencias entre los BP estudiados en cuanto a la prevención de fracturas, mientras, en otros dos, el zoledronato se mostró más eficaz que otros BP.
Efectos adversos de los bisfosfonatosGeneralmente los BP son bien tolerados. En algunos pacientes los BP orales pueden producir esofagitis. Deben evitarse en enfermos con dificultad para la deglución o esófago de Barret. La reacción de fase aguda o cuadro seudogripal autolimitado es frecuente tras la primera dosis de zoledronato. Los BP se desaconsejan en pacientes con filtrado glomerular (FG) ≤30mL/min. Los BP intravenosos pueden producir hipocalcemia, especialmente en pacientes con insuficiencia renal o aporte insuficiente de vitaminaD o calcio.
La osteonecrosis de maxilares (ONM) es infrecuente, pero potencialmente grave. El riesgo en pacientes tratadas con BP por osteoporosis es muy bajo (1/1.500-1/100.000 pacientes-año). Guarda relación con el estado de salud bucal (periodontitis) y los procedimientos dentales.
Las fracturas atípicas de fémur (FAF) se dan en 1-2 casos por cada 10.000 pacientes tratadas con BP. El riesgo aumenta con el tiempo de exposición, pero es muy bajo en comparación con el riesgo de fracturas osteoporóticas. Por cada FAF que pudiera aparecer se previenen unas 270 fracturas clínicas por fragilidad, incluyendo 70 fracturas de cadera8.
DenosumabEl denosumab disminuye el riesgo de fractura vertebral, no vertebral y de cadera en torno al 70%, al 20% y al 40%, respectivamente9.
En general es bien tolerado. El riesgo de FAF y ONM es muy bajo, en torno a 1/10.000 y 1/2.000 pacientes/año, respectivamente. Se puede utilizar en pacientes con insuficiencia renal, incluso en diálisis. Debe asegurarse un aporte adecuado de calcio y de vitaminaD para evitar la hipocalcemia.
Tras su suspensión se observa un aumento de los MRO y una pérdida de la DMO ganada. En algunas pacientes ello se asocia a fracturas vertebrales múltiples.
PTH 1-34 (teriparatida)La teriparatida ejerce un efecto osteoformador. Consigue reducciones del riesgo de fractura vertebral del 65% y de fracturas no vertebrales del 50%. Un metaanálisis no demostró reducción significativa de las fracturas de cadera, pero otros tres concluyeron que las disminuía en un 56-65%. Se demostró más eficaz que el risedronato en mujeres con osteoporosis grave10. Están comercializados varios análogos biológicos y biosimilares.
AbaloparatidaLa abaloparatida reduce las fracturas vertebrales y no vertebrales. Este fármaco está aprobado en Estados Unidos, pero no en Europa.
RomosozumabEl romosozumab es un anticuerpo neutralizante de la esclerostina con efecto dual, anabólico y antirresortivo.
Según varios metaanálisis5,11, reduce las fracturas vertebrales (66-73%), no vertebrales (33%) y de cadera (56%). En mujeres con osteoporosis grave, un ciclo de romosozumab aportó beneficios adicionales al alendronato12.
En general es bien tolerado, pero en algunos estudios se ha descrito un pequeño aumento de eventos cardiovasculares (1,3% frente al 0,9%), por lo que se considera contraindicado en pacientes con antecedentes de infarto de miocardio o accidente cerebrovascular y debe considerarse cuidadosamente en los que tienen varios factores de riesgo cardiovascular.
Vertebroplastia y cifoplastiaAunque muchos estudios no controlados han mostrado un efecto antiálgico marcado, los ensayos clínicos aleatorizados han ofrecido resultados contradictorios sobre la vertebroplastia y la cifoplastia. Por tanto, no se recomiendan de manera sistemática.
Pueden considerarse en pacientes con fracturas de menos de 6 semanas de evolución y dolor intenso a pesar del tratamiento médico, y en pacientes con fracturas de 6 semanas a un año de evolución y dolor persistente que responde mal a los analgésicos, si presentan signos de edema en la resonancia magnética.
Inicio y seguimiento del tratamientoDecisión de iniciar el tratamientoEn general, se han de tratar las pacientes con algunas de estas características:
- 1.
Una o más fracturas por fragilidad, especialmente de vértebras, cadera, húmero y pelvis (con independencia de la DMO).
- 2.
DMO ≤−2,5 T en columna lumbar, cuello femoral o cadera total.
- 3.
DMO en rango de «osteopenia» (particularmente si la T es ≤−2,0) junto a factores fuertemente asociados con el riesgo de fractura (p.ej., hipogonadismo o menopausia precoz, tratamiento con glucocorticoides o antiestrógenos, etc.).
No obstante, existen situaciones que requieren una valoración individualizada de las características clínicas. Así, en mujeres jóvenes que presentan solo una DMO discretamente baja, sin fracturas ni otros factores de riesgo, se puede considerar retrasar el inicio del tratamiento, pues el riesgo absoluto de fractura es bajo. Al contrario, la coincidencia de varios factores de riesgo importantes puede llevar a considerar más precozmente el tratamiento. Las escalas que ayudan a estimar el riesgo de fractura (p.ej., FRAX) pueden ser de ayuda, aunque su validez en la población española es limitada.
Control de la respuesta terapéuticaSi fuera preciso, la adherencia a los tratamientos se puede controlar mediante los MRO, cuyos cambios predicen la respuesta terapéutica.
El efecto beneficioso del tratamiento se confirma por la evolución de la DMO y la ausencia de nuevas fracturas. Puede plantearse el cambio de tratamiento por posible respuesta inadecuada si aparecen dos fracturas nuevas durante el tratamiento o se dan dos de los siguientes hechos: una nueva fractura, disminución significativa de la DMO (p.ej., 4-5%) o descenso de los MRO inferior al mínimo cambio significativo (25% aproximadamente).
Duración del tratamientoSe deben considerar varios aspectos.
Aunque la estrategia treat to target es teóricamente atractiva, los objetivos que se han de alcanzar en el tratamiento de la osteoporosis no están bien definidos, lo que limita su aplicación práctica. Para algunos expertos, la ausencia de nuevas fracturas y el aumento de la DMO serían los más apropiados. Diferentes expertos han recomendado como objetivo un valor de T superior a −2,0 o −2,5, especialmente en cadera.
Varios estudios han mostrado la persistencia del efecto manteniendo zoledronato durante 6años, o alendronato o denosumab durante 10años. Sin embargo, los efectos secundarios (particularmente la ONM y las FAF) pueden aumentar con la duración del tratamiento. Por ello, se recomienda reevaluar las pacientes tratadas con BP a los 3 (zoledronato) o 5años (BP orales) y las tratadas con denosumab, a los 5-10años.
El tratamiento debe mantenerse (con el mismo fármaco o con otro) si se da alguna de las siguientes circunstancias:
- a.
DMO en cuello de fémur <−2,5 T.
- b.
Aparición de fracturas por fragilidad en los 3-5años anteriores a la evaluación.
- c.
Algunos expertos recomiendan también mantener el tratamiento si el paciente tiene antecedentes de fractura de cadera o vertebral en algún momento de la vida.
Si no se da ninguna de estas circunstancias, el tratamiento con BP puede retirarse, al menos temporalmente («vacaciones terapéuticas»): durante 1año el risedonato, 2años el alendronato y 3años el zoledronato. En el caso del denosumab no se deben plantear interrupciones temporales.
Tratamiento secuencial y combinadoBisfosfonatos tras denosumabTras la suspensión de denosumab, el recambio óseo aumenta más allá de los valores basales («efecto rebote»). Ello se asocia a una rápida disminución de la masa ósea ganada y, en algunos casos, fracturas vertebrales. Para evitarlo, se debe administrar un BP potente13. Se recomienda prescribir la primera dosis de zoledronato al suspender denosumab (es decir, a los 6meses de la última dosis) y repetirla cuando se detecten elevaciones de los MRO, en general a los 6 o 12meses.
Si no se pueden medir los MRO, se podría repetir la administración de zoledronato a los 6 y a los 12meses13 de la anterior y considerar individualmente la necesidad de nuevas dosis. En pacientes que hayan recibido denosumab durante menos de 2,5años cabe utilizar alendronato en vez de zoledronato.
Agentes antirresortivos tras anabólicosTras finalizar el tratamiento con fármacos anabólicos, como teriparatida o romosozumab, se recomienda la administración de un BP o denosumab.
Fármacos anabólicos tras antirresortivosEl uso previo de BP reduce ligeramente la ganancia de DMO obtenida con teriparatida. Por eso, la secuencia preferida es primero un fármaco anabólico y después un antirresortivo. No obstante, el tratamiento previo con BP no contraindica la administración de anabólicos. Eso sí, no se debe comenzar teriparatida como único tratamiento en los meses siguientes a suspender denosumab, dado el riesgo de pérdida acelerada de masa ósea.
Tratamiento combinadoNo existen ensayos suficientes para recomendarlo de forma general. La combinación de teriparatida con denosumab o zoledronato puede considerarse en casos particularmente graves con alto riesgo de fractura de cadera.
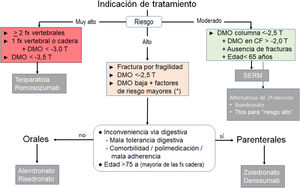
Algoritmos de decisión terapéuticaTratamiento inicial (elección de fármaco, fig. 1)El principal criterio para la elección del fármaco inicial es el nivel de riesgo de fractura:
- 1.
Riesgo moderado. Corresponde al perfil de riesgo de una mujer de menos de 65años, sin antecedentes de fractura, DMO moderadamente baja en columna (T entre −2,5 y −3,0) y preservada en cadera (T>−2). Para esta situación es aconsejable utilizar un SERM y retrasar así el uso de fármacos con posibles efectos adversos a largo plazo. El ibandronato y otros antirresortivos son opciones alternativas.
- 2.
Riesgo alto. Corresponde a la mayor parte de los casos. Están indicados el alendronato, el risedronato, el zoledronato y el denosumab. Se prefieren los BP orales en pacientes sin inconvenientes para la administración oral (problemas digestivos, polimedicación, adherencia) y preferentemente edad inferior a 75años.
- 3.
Riesgo muy alto. Corresponde a mujeres con: a)dos o más fracturas vertebrales, o situación equivalente (p.ej., fractura vertebral y de cadera); b)DMO muy baja (T<−3,5), o c)fractura vertebral o de cadera junto a T<−3,0. Puede haber otras situaciones, difícilmente sistematizables, en las que los factores clínicos determinen un riesgo de fractura muy alto y que requieren una consideración individualizada. Para este nivel de riesgo son preferibles los fármacos osteoformadores.
Algoritmo de selección del tratamiento inicial en la osteoporosis posmenopáusica.
CF: cuello femoral; DMO: densidad mineral ósea; fx: fractura; SERM: modulador selectivo del receptor de estrógenos; Ttos: tratamientos.
* Sobre todo si T ≤−2 y hay factores fuertemente asociados con el riesgo de fractura, como hipogonadismo, menopausia precoz, o tratamiento con glucocorticoides o antagonistas de hormonas sexuales. Estos criterios generales pueden necesitar adaptación en virtud de otros factores clínicos determinantes del riesgo de fractura, de las características de los pacientes individuales y de sus preferencias.
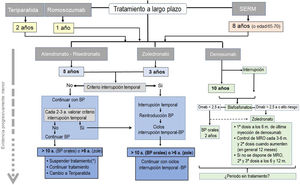
El romosozumab solo debe administrarse durante 1año y la teriparatida durante 2años. Los SERM se pueden mantener durante 8años o hasta que la paciente llega a los 65-70años. Después será necesario administrar otro antirresortivo, BP o denosumab.
Algoritmo de continuación del tratamiento a largo plazo.
BP: bisfosfonatos; MRO: marcadores de recambio óseo; SERM: moduladores selectivos del receptor de estrógenos.
* No existen datos suficientes para establecer una recomendación pasado ese tiempo de tratamiento, por lo que se enumeran las opciones posibles ante una decisión que deberá ser individualizada.
Se preconiza el uso continuado de denosumab durante 5-10años. No se dispone de información respecto a un uso más prolongado, por lo que, llegado ese momento, deberá valorarse cuidadosamente continuar el tratamiento o suspenderlo. En todo caso, después debe administrarse un BP.
Tras el ciclo inicial de tratamiento con BP, se puede valorar interrumpirlo si se cumplen los requisitos necesarios para iniciar unas «vacaciones terapéuticas» (ver el apartado «Duración del tratamiento»). No se dispone de estudios de calidad para guiar la toma de decisiones después de 10años.
Osteoporosis del varónLa mayor parte de los fármacos han mostrado ganancias de DMO parecidas a las observadas en mujeres, lo que hace pensar que su eficacia sobre las fracturas sea también similar. De hecho, el alendronato, el risedronato y el zoledronato han demostrado reducir las fracturas vertebrales en varones. El denosumab ha demostrado aumentar las DMO en varones y reducir el riesgo de fractura en los sometidos a deprivación androgénica. También la teriparatida ha mostrado efectos beneficiosos en varones14. Por esta razón, cabe plantear para el varón una estrategia de elección de fármaco similar a la de la mujer: a)risedronato o alendronato (aunque este último no está aprobado en España para el tratamiento de la osteoporosis masculina) como tratamiento de elección para la mayoría de los pacientes; b)zoledronato o denosumab en los de mayor edad o cuando no sea conveniente la vía oral, y c)teriparatida en pacientes de muy alto riesgo.
Osteoporosis inducida por glucocorticoidesLos fármacos de elección son los BP. Si existen fracturas vertebrales, está justificado el tratamiento preferente con teriparatida por su mayor efecto antifracturario15. Deben administrarse también calcio y vitaminaD.
Deben tratarse las mujeres posmenopáusicas y los varones de más de 50años que vayan a recibir dosis ≥5mg/día de prednisona durante más de 3meses. En mujeres premenopáusicas y varones <50años el tratamiento está indicado solo si existen fracturas previas, la DMO es baja o la dosis de glucocorticoides es muy elevada (>30mg/día).
El denosumab es una alternativa cuando no sea posible utilizar otros antirresortivos.
FinanciaciónEstas guías se han realizado con el apoyo administrativo de la SEIOMM, sin que haya contado con financiación pública o privada.
Conflicto de interesesLos conflictos de intereses individuales de los autores que los tienen son:
Antonio Cano: honorarios por conferencias (Gedeon Richter) y consejos consultivos (Theramex). Cristina Carbonell Abella: honorarios por conferencias (Amgen, UCB, Stada, Theramex, Angelini, Gebro) y bolsas de viaje (Amgen, Rubio). Enrique Casado Burgos: honorarios por conferencias (Ucb, Gedeon-Richter, Stada, Grunenthal, Lilly, Amgen, Theramex, Gebro, Italfarmaco, Angelini), bolsas de viaje (Lilly, Amgen, Stada) y consejos consultivos (Theramex, Bayern, Gp-Pharm, Gebro, Gedeon-Richter, Stada). Manuel Ciria Recasens: honorarios por conferencias (Grunenthal, Angelini, Gedeon Richter, Theramex, Rubio, Gebro Pharma) y bolsas de viaje (Amgen, Lilly, Rubio). Javier del Pino Montes: honorarios por conferencias (Gedeon-Ritcher, Grünenthal, Ucb) y bolsas de viaje (Amgen). Luis Miguel del Rio Barquero: honorarios por conferencias (Amgen, Gedeon-Richter). Manuel Díaz Curiel: bolsas de viaje (Rubio). Adolfo Díez Pérez: acciones, empleado (Active Life Sci) y honorarios por conferencias (Amgen, Lilly, Theramex). Alberto García Vadillo: honorarios por conferencias (Lilly. Amgen. Gebro-Pharma. Theramex) y bolsas de viaje (UCB. Lilly. Amgen). Carlos Gómez Alonso: acciones (Faes), honorarios por conferencias (Stada, Grünenthal, Amgen, UCB), bolsas de viaje (Amgen), becas de investigación (Stada, Kiowa Kirin, FAES) y consejos consultivos (Amgen, Kiowa Kirin). Jesús González Macías: honorarios por conferencias (Amgen-UCB, Gedeon Richter, Menarini, Theramex), bolsas de viaje (Lilly) y becas de investigación (Faes). Nuria Guañabens: honorarios por conferencias (Eli Lilly, Amgen, UCB), bolsas de viaje (Eli Lilly, Amgen, UCB) y consejos consultivos (Amgen, UCB). Esteban Jodar Gimeno: acciones, empleado (SICAM SL, Cajal PME, H&B), honorarios por conferencias (Amgen, Asofarma, Astelas, Astra-Zeneca, Bayer, Boehringer Ingelheim, Faes, Janssen, Lilly, Msd, Novartis, Novo Nordisk, Viatrix), bolsas de viaje (Amgen, Lilly, Novonordisk, UCB), becas de investigación (Amgen, Astra-Zeneca, Boehringer Ingelheim, Faes, Janssen, Lilly, Msd, Novo Nordisk Pfizer & Sanofi) y consejos consultivos (Amgen, Astrazeneca, Faes, Fresenius, Italfármaco, Janssen, Lilly, Msd, Mundipharma, Novo Nordisk, Shire & Ucb). Jorge Malouf Sierra: honorarios por conferencias (Theramex, Amgen, Anghelini), bolsas de viaje (Lilly) y consejos consultivos (Amgen, UCB). Guillermo Martínez Díaz-Guerra: honorarios por conferencias (Lilly, Amgen, Ucb, Angelini Pharma, Italfarmaco, Kyowa Kirin), bolsas de viaje (Lilly, Amgen, UCB), becas de investigación (Amgen) y consejos consultivos (Lilly, Amgen, Ucb, Alexion, Shire, Kyowa Kirin). Ana Monegal Brancos: bolsas de viaje (Amgen, Lilly). Manuel Muñoz Torres: honorarios por conferencias (Amgen, Ucb, Grünenthal Pharma, Stada, Meiji, Gedeon Richter, Ferrer) y consejos consultivos (Amgen, UCB, Meiji). Manuel Naves Díaz: honorarios por conferencias (Grünenthal, Gedeon Richter) y bolsas de viaje (Amgen, Ucb). Xavier Nogués: honorarios por conferencias (Ucb,Amgen,Lilly,Faes,Italfarmaco), bolsas de viaje (Amgen) y consejos consultivos (UCB, Amgen). Joan M Nolla: honorarios por conferencias (Amgen, Lilly) y bolsas de viaje (Amgen, Lilly). José Luis Pérez-Castrillón: honorarios por conferencias (Msd, Lilly, Amgen, Ucb, Gedeon-Ritcher, Gruggental), bolsas de viaje (Gedeon-Ritcher, Msd, Amgen, Italfarmaco), becas de investigación (Pfizer) y consejos consultivos (Faes). Pilar Peris Bernal: honorarios por conferencias (Amgen, UCB, Lilly, Kyowa Kirin). José Manuel Quesada Gómez: honorarios por conferencias (Amgen, Faes, Ferrer, Gebro Pahrma, Grünental, Procare Health Iberia, S. L., Theramex), bolsas de viaje (Amgen, Faes), becas de investigación (Faes) y consejos consultivos (Amgen, Shire). José A. Riancho: honorarios por conferencias (Amgen, Ucb, Lilly, Merck), bolsas de viaje (Amgen, UCB, Lilly, Merck, Takeda) y becas de investigación (Alexion, Kyowa-Kirin). Minerva Rodríguez García: honorarios por conferencias (Amgen, Kiowa Kyrin), bolsas de viaje (Rubió, Amgen, Vifor). Carmen Valero Díaz de Lamadrid: honorarios por conferencias (Amgen).
El listado con los nombres de la Comisión de Redacción de las Guías de Osteoporosis de la SEIOMM se encuentra en el Anexo 1.
Este documento se publica simultáneamente en las revistas Revista de Osteoporosis y Metabolismo Mineral (https://doi.org/10.4321/S1889-836X2022000100002) y Revista Clínica Española (https://doi.org/10.1016/j.rce.2021.12.007), con el consentimiento de los autores y editores.