La anemia perioperatoria constituye un factor independiente de riesgo de morbimortalidad posoperatoria. Sin embargo, persisten barreras conceptuales, logísticas y administrativas que dificultan la implementación generalizada de protocolos para su manejo. El coordinador del proyecto convocó a un grupo multidisciplinar de ocho profesionales para elaborar un documento de consenso sobre el manejo de la anemia perioperatoria, con base a en serie puntos claves (PCs) relativos a su prevalencia, consecuencias, diagnóstico y tratamiento. Estos PCs fueron evaluados utilizando una escala Likert de 5 puntos, desde «totalmente en desacuerdo [1]» a «totalmente de acuerdo [5]». Cada PC se consideró consensuado si recibía una puntuación de 4 o 5 por al menos siete participantes (> 75%). A partir de los 36 PCs consensuados, se construyeron algoritmos diagnóstico-terapéuticos que pueden facilitar la implementación de programas de identificación precoz y manejo adecuado de la anemia perioperatoria, adaptados a las características de las instituciones hospitalarias de nuestro país.
Perioperative anemia is an independent risk factor for postoperative morbidity and mortality. However, conceptual, logistical and administrative barriers persist that hinder the widespread implementation of protocols for their management. The project coordinator convened a multidisciplinary group of 9 experienced professionals to develop perioperative anemia management algorithms, based on a series of key points (KPs) related to its prevalence, consequences, diagnosis and treatment. These KPs were assessed using a 5-point Likert scale, from “strongly disagree [1]” to “strongly agree [5]”. For each KP, consensus was reached when receiving a score of 4 or 5 from at least 7 participants (>75%). Based on the 36 KPs agreed upon, diagnostic-therapeutic algorithms were developed that we believe can facilitate the implementation of programs for early identification and adequate management of perioperative anemia, adapted to the characteristics of the different institutions in our country.
La anemia preoperatoria es prevalente y se asocia a un incremento del riesgo de transfusión y de complicaciones posoperatorias, a una estancia hospitalaria más prolongada e, incluso, a mayor mortalidad1. Además, puede potenciar los efectos deletéreos del sangrado y la transfusión2. Tras una cirugía con pérdida significativa de sangre, la anemia posoperatoria es aún más frecuente y también se asocia con un peor resultado clínico3.
De ahí que el tratamiento de la anemia perioperatoria constituya uno de los pilares fundamentales de la gestión de la sangre del paciente (Patient Blood Management, PBM), un programa multimodal y multidisciplinar, centrado en el paciente y basado en la evidencia, que mejora sus resultados clínicos, al tiempo que promueve su seguridad4. Recientemente, la Organización Mundial de la Salud (OMS) ha insistido en la urgencia de la implementación del PBM a nivel global5.
De acuerdo con las recomendaciones internacionales, todas las instituciones en las se realicen procedimientos quirúrgicos deberían disponer de protocolos para el manejo de la anemia perioperatoria3,6–11. Sin embargo, aún persisten barreras conceptuales, logísticas y administrativas que dificultan la implementación generalizada de estos12.
Por ello, el objetivo de este proyecto fue el de elaborar un documento multidisciplinar de consenso que pueda ser útil para el desarrollo e implementación de protocolos de manejo de la anemia perioperatoria, adaptables a las características de las diferentes instituciones hospitalarias españolas.
MétodosSe planteó un proyecto multidisciplinar cuyo coordinador convocó a un grupo multidisciplinar de ocho profesionales expertos en este ámbito: medicina interna (dos), anestesiología (dos), hematología (dos), ginecología (uno) y medicina de familia (uno). Tras la revisión de diversas guías de práctica clínica y documentos de consenso3,6–13, el coordinador elaboró un borrador de cuestiones relativas a la anemia perioperatoria que debían ser abordadas en el panel de consenso. Esas preguntas estaban distribuidas en cuatro bloques: 1) ¿por qué y para qué pacientes es importante? 2) ¿cómo detectarla y clasificarla? 3) ¿cuáles son las opciones de tratamiento disponibles en España? y 4) ¿cómo implementar un protocolo/circuito de manejo (algoritmos)?
En una primera reunión del panel, se realizó la presentación de los objetivos y metodología del proyecto, se discutió el documento preliminar elaborado por el coordinador y se acordó el contenido final que debería abarcar el mismo. Los participantes divididos en cuatro grupos elaboraron las respuestas para cada una de las cuestiones acordadas, en forma de serie de puntos claves (PCs), incluyendo una breve justificación de las mismas y las referencias bibliográficas que las apoyaban.
Los PCs elaborados por cada grupo fueron fusionados en un solo documento y distribuido entre todos los participantes para su evaluación. Esta se realizó utilizando una escala Likert de 5 puntos, de «totalmente en desacuerdo (uno)» a «totalmente de acuerdo (cinco)». Además de la valoración, los miembros del panel podían incluir comentarios en forma de texto libre. Para cada PC, se consideró que se alcanzaba el consenso si recibía una puntuación de 4 (de acuerdo) o 5 (totalmente de acuerdo) de al menos 7 de los nueve participantes (> 75%).
Los resultados de la evaluación fueron presentados y discutidos en una segunda reunión de los miembros del panel. En aquellos PCs en los que no se había alcanzado el consenso, se procedió a modificar su redacción, en base a los comentarios recibidos y la discusión del grupo, y a reevaluar el grado de acuerdo sobre el PC modificado, utilizando la misma escala Likert. También se matizó la redacción de algunos PCs en los que, aun habiéndose alcanzado el consenso, existía alguna opinión en desacuerdo. En dicha reunión también fueron presentados, discutidos, modificados y aprobados los algoritmos correspondientes al bloque 4 (figs. 1-3).
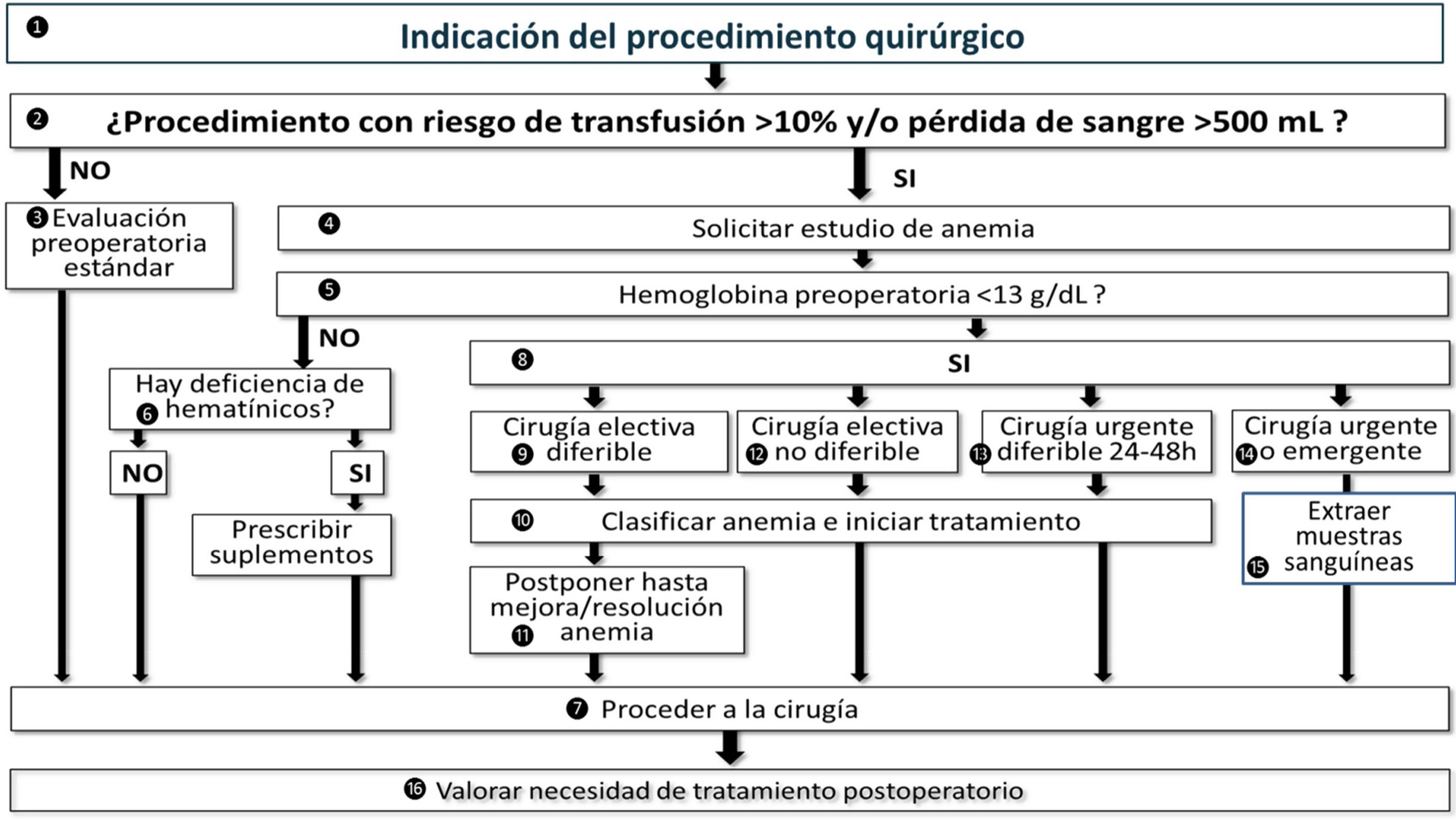
Vía clínica de manejo de la anemia perioperatoria
El equipo quirúrgico que propone la cirugía debe poner en marcha el proceso (1) y valorar el riesgo hemorrágico/transfusional de la intervención (2). Si no hay riesgo hemorrágico/transfusional, se solicita la evaluación preoperatoria estándar para esa intervención (3). Si en ella se objetiva la presencia de anemia, esta debe ser investigada y tratada, sin que ello comporte posponer la cirugía. En caso de intervención con riesgo hemorrágico/transfusional, se solicitan las pruebas de laboratorio para la detección y clasificación de la anemia (4). También debería hacerse para los pacientes que presentan anemia conocida, causada o no por la patología que requiere de cirugía (sangrado crónico), y en aquellos que presenta factores de riesgo adicionales que pueden elevar la probabilidad de hemorragia (p. ej., tratamiento con anticoagulantes o antiagregantes plaquetarios), aunque la cirugía no comporte riesgo hemorrágico/transfusional. Se debería hacer la extracción de sangre en esa misma visita (coordinación con la sala de extracciones). En caso cirugía electiva no diferible (p. ej., cáncer de colon) se podría determinar la presencia de anemia mediante un dispositivo point of care en sangre venosa. Esto permitiría el inicio inmediato del tratamiento empírico de la misma (p. ej., administración de hierro IV) en hospital de día o consulta de anemia. Los resultados de la analítica deben estar disponibles a la mayor brevedad posible para los posibles profesionales implicados (cirugía/ medicina de familia/medicina interna/anestesia/hematología). Si la Hb es ≥13g/dL (5), se comprobará si hay deficiencia de hematínicos (hierro, fólico, vit B12) (6), para administrar los suplementos pertinentes, en su caso, y proceder a la cirugía (7). Si la Hb es <13g/dL (8), el manejo del paciente dependerá de la gravedad de la anemia y el tiempo disponible hasta la cirugía: Cirugía electiva diferible (9): clasificar anemia e iniciar tratamiento, comprobar la eficacia del mismo al menos dos semanas antes de la cirugía (10), considerar posponer la cirugía hasta conseguir la corrección de la anemia (11); Cirugía electiva no diferible (12) clasificar anemia e iniciar tratamiento (10), proceder a la cirugía en la fecha programada (7); Cirugía urgente diferible 24-48h (13): clasificar anemia e iniciar tratamiento en hospitalización (10), según etiología o empírico (cirujano, anestesiólogo, internista, hematólogo), y proceder a la cirugía (7); Cirugía urgente o emergente(14), extraer muestras sanguíneas al ingreso para clasificación de la anemia (15) e inicio del tratamiento en el posoperatorio. En todos los casos, valorar la necesidad de tratamiento posoperatorio (fig. 3).
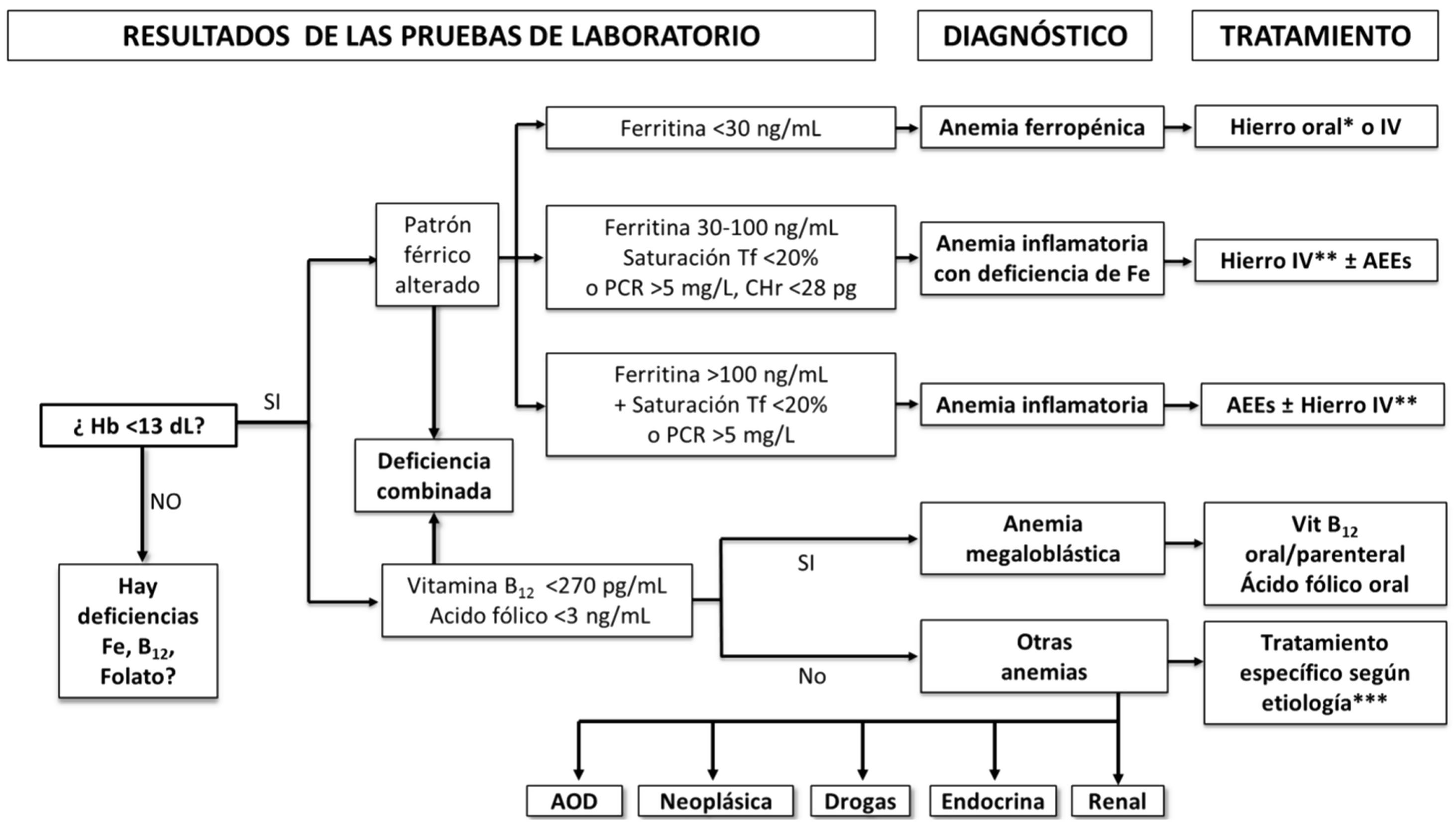
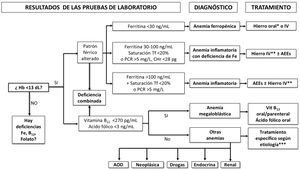
Algoritmo diagnóstico-terapéutico de la anemia preoperatoria
AEE: agente estimulador de la eritropoyesis; AOD: anemia de origen desconocido; Hb: hemoglobina; CHr: contenido de Hb reticulocitaria; Hierro IV: hierro intravenoso (preferentemente, formulaciones que permiten la administración rápida de dosis altas); PCR: proteína C-reactiva; Tf: transferrina.
*Hierro oral convencional o hierro sucrosomado.
**Hierro IV, hierro intravenoso (preferentemente, formulaciones que permiten la administración rápida de dosis altas) o hierro sucrosomado (si hay tiempo suficiente antes de la cirugía, especialmente si existen dificultades para implementar la logística de administración del hierro IV).
***En la mayoría de los casos, el tratamiento será la administración de un AEE.
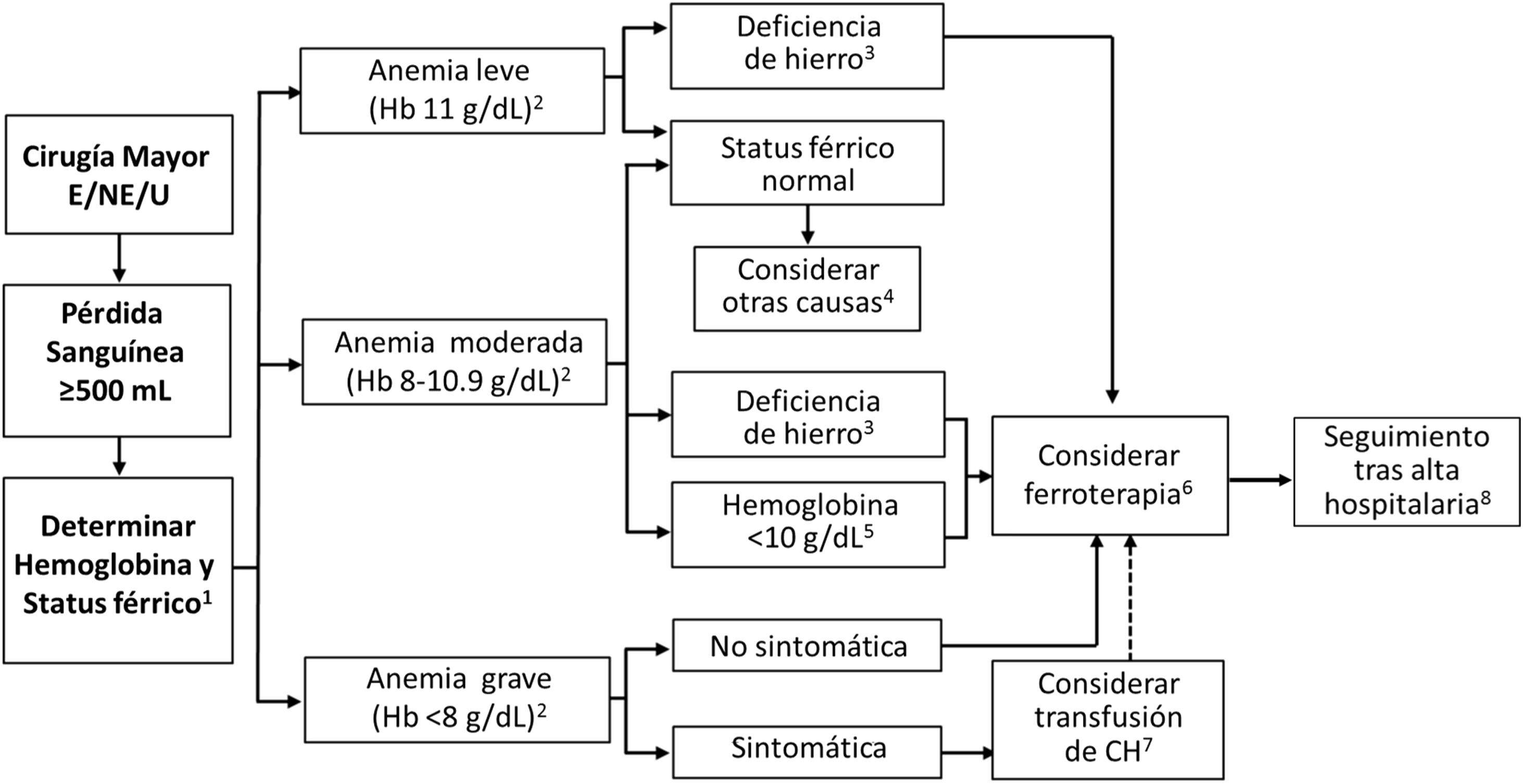
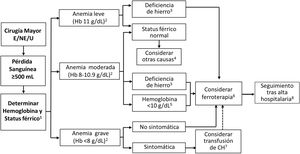
Algoritmo diagnóstico-terapéutico de la anemia posoperatoria
Siempre que sea posible, evaluar el estatus férrico dentro de las primeras 24 horas posoperatorias, si no se ha realizado ya en la evaluación preoperatoria (1). En pacientes sin sangrado posoperatorio, controlar la hemoglobina a las 24 y 72-96 horas después de la intervención (1). Valorar la presencia y gravedad de la anemia según los criterios de la OMS: Hb <12g/dL para mujeres, Hb <13g/dL para hombres (2). La deficiencia posoperatoria de hierro se define por ferritina <100 ng/mL, ferritina <300 ng/mL y saturación de transferrina <20% o hemoglobina reticulocitaria <28 pg (3). Si no hay deficiencia de hierro, considerar otras causas (4). Considerar ferroterapia (6), preferentemente IV en casos de anemia leve o moderada con deficiencia de hierro (3) o Hb <10g/dL debida a anemia preoperatoria o sangrado quirúrgico abundante, independientemente del status férrico (5). En pacientes con anemia posoperatoria grave o que declinan la transfusión, considerar la adición de un AEE al tratamiento con hierro IV, aunque existe poca evidencia sobre su uso en este contexto y debe valorarse caso por caso. En pacientes con anemia grave sintomática, considerar TCH si el paciente consiente, transfundiendo las unidades de una en una, con reevaluación de las necesidades adicionales (7). Considerar la administración de suplementos de hierro IV o hierro sucrosomado después de la transfusión, utilizando la hemoglobina pos-transfusión para el cálculo de la deficiencia total de hierro (6). Realizar seguimiento del paciente tras el alta hospitalaria (8).
Finalmente, se elaboró una tabla matriz en la que se resumió los PCs y los resultados de la votación (participantes de acuerdo o totalmente de acuerdo/participantes totales), los comentarios recibidos para cada uno de ellos, y los PCs resultantes de la segunda reunión. Con dicha información, el coordinador elaboró un borrador de manuscrito que se circuló entre todos los expertos para su revisión crítica, comentarios ulteriores y aprobación del documento final.
Este documento de consenso (Anexo 1) ha sido avalado por la Sociedad Española de Medicina Interna (SEMI), Sociedad Española de Hematología y Hemoterapia (SEHH) y el Grupo Cooperativo Iberoamericano de Medicina Transfusional (GCIAMT).
ResultadosBloque 1. ¿Por qué y para qué pacientes es importante el manejo de la anemia perioperatoria?- •
Punto clave 1. En promedio, la anemia preoperatoria afecta a uno de cada tres pacientes quirúrgicos, y se asocia con peores resultados clínicos posoperatorios. [9/9]
- •
Punto clave 2. La anemia posoperatoria afecta a una elevada proporción de los pacientes intervenidos de cirugía mayor sangrante y también se asocia con peores resultados clínicos. [9/9]
- •
Punto clave 3. Se debería detectar, clasificar y tratar la anemia preoperatoria, al menos, en los pacientes que requieren de un procedimiento quirúrgico, electivo o no electivo, en el que la probabilidad de requerir transfusión de concentrado de hematíes (TCH) sea >10% y/o en el que se espera un sangrado> 500mL o> 10% del volumen sanguíneo (fig. 1). [8/9]
- •
Punto clave 4. También son candidatos para su inclusión es este programa aquellos pacientes que presentan una anemia conocida u originada por la patología que requiere de un tratamiento quirúrgico, aunque este no conlleve un sangrado mayor de 500mL o del 10% del volumen sanguíneo. [8/9]
- •
Punto clave 5. Es discutible la necesidad del incluir en este programa de estudio de la anemia preoperatoria a aquellos pacientes que requieren de un procedimiento de cirugía menor o con riesgo hemorrágico bajo (excepto en aquellos pacientes que presenten factores de riesgo hemorrágicos adicionales). No obstante, si en la evaluación preoperatoria estándar se detecta la presencia de anemia, esta debe ser estudiada y tratada mientras se procede a la cirugía, aunque no necesariamente en un programa de optimización. [8/9]
- •
Punto clave 6. Se debe investigar la presencia y gravedad de la anemia posoperatoria en todos los pacientes intervenidos de cirugía mayor que presentaban anemia en el momento de la cirugía o hayan tenido una pérdida perioperatoria de sangre de moderada a grave (fig. 1). [8/9]
- •
Punto clave 7. Todas las instituciones en las se realicen procedimientos de cirugía mayor deberían disponer de un protocolo para el manejo de la anemia perioperatoria y las deficiencias de hematínicos. [9/9]
- •
Punto clave 8. Para aquellas cirugías en las que la probabilidad de TCH sea> 10% y/o en las que se espera un sangrado> 500mL o> 10% del volumen sanguíneo, la anemia preoperatoria debe definirse por una Hb <13g/dL, independientemente del sexo del paciente (fig. 1). [9/9]
- •
Punto clave 9. Para aquellas cirugías en las que la probabilidad de TCH sea <10% y/o el sangrado esperado sea <500mL o <10% del volumen sanguíneo, la anemia preoperatoria podría definirse de acuerdo a los criterios de la OMS: Hb <12g/dL en mujeres no gestantes y Hb <13g/dL en hombres. [9/9]
- •
Punto clave 10. La anemia posoperatoria podría definirse de acuerdo a los criterios de la OMS: Hb <12g/dL en mujeres no gestantes y Hb <13g/dL en hombres. [9/9]
- •
Punto clave 11. En todos los pacientes programados para cirugía con riesgo de sangrado y/o transfusión, se debería solicitar, al menos, hemograma completo con reticulocitos (y Hb reticulocitaria, si está disponible), y la determinación de parámetros férricos (hierro, ferritina, transferrina y saturación de transferrina), vitamina B12, folato, creatinina (filtrado glomerular estimado) y de un marcador de inflamación (proteína C reactiva [PCR]) (fig. 2). [8/9]
- •
Punto clave 12. En procedimientos electivos, la detección y clasificación de la anemia preoperatoria debe realizarse al hacer la indicación quirúrgica o al menos cuatro semanas antes de la cirugía. Sin embargo, cualquier periodo previo a la cirugía, aunque sea mínimo, es válido para detectar la presencia de anemia e iniciar el tratamiento, en su caso (fig. 1). [8/9]
- •
Punto clave 13. En los pacientes de cirugía no electiva, urgente o emergente, se deberían extraer muestras sanguíneas antes del procedimiento, idealmente en el momento de su ingreso, para detectar y clasificar la anemia e iniciar su tratamiento perioperatorio lo antes posible (fig. 1). [8/9]
- •
Punto clave 14. Existen diferentes formas de alteración de la homeostasis férrica (fig. 2):
- -
Deficiencia de hierro absoluta: ferritina <30 ng/mL.
- -
Deficiencia de hierro en inflamación (doble trastorno): ferritina <100 ng/mL, si índice de saturación de transferrina (IST) <20% o hemoglobina reticulocitaria <28 pg y/o PCR> 5mg/L.
- -
Deficiencia funcional de hierro o secuestro férrico (anemia inflamatoria): ferritina> 100 ng/mL con IST <20% y PCR> 5mg/L
- -
Depósitos de hierro insuficientes: ferritina 30-100 ng/mL e IST>20%. [8/9]
- -
- •
Punto clave 15. Generalmente se acepta que una concentración de vitamina B12 sérica> 270 pg/mL y de ácido fólico sérico> 3-5 ng/mL (dependiendo del laboratorio) descartan la deficiencia de estos factores madurativos, pero pueden necesitarse pruebas de laboratorio adicionales para confirmarlo (fig. 2). [8/9]
- •
Punto clave 16. La determinación rutinaria de los niveles basales de eritropoyetina (Epo) en el cribado de la anemia preoperatoria no se considera costo-efectiva. [9/9]
- •
Punto clave 17. Se debe derivar al paciente para estudio y tratamiento de la anemia cuando esta no esté justificada por la patología que indica la intervención quirúrgica, especialmente en casos de deficiencia de hierro, insuficiencia renal, anemia inflamatoria no filiada, anemia macrocítica no justificada por hepatopatía y/o déficit de B12/folato o cualquier otra anemia que se acompañe de otra citopenia. Sería prioritario el estudio de estas anemias en una consulta de resolución rápida, para minimizar el posible retraso de la cirugía. [7/9]
- •
Punto clave 18. Después de una cirugía mayor sangrante se requiere al menos una determinación de Hb en las primeras 24 horas. En pacientes estables se aconseja realizar una nueva determinación al tercer o cuarto día posoperatorio (cuando se alcanza el nadir de Hb) para detectar la presencia de anemia y la gravedad de la misma, e iniciar el tratamiento, en su caso (fig. 3). En pacientes con sangrado posoperatorio persistente, estaría justificado el control diario de la Hb. [9/9]
- •
Punto clave 19. Durante la hospitalización posoperatoria, si se sospecha deficiencia de hierro y no se dispone de datos preoperatorios, esta debe definirse por ferritina <100 ng/mL o ferritina <300 ng/mL y saturación de transferrina <20%, pero pueden necesitarse pruebas de laboratorio adicionales para confirmarla, como una hemoglobina reticulocitaria <28 pg (o parámetros equivalentes) o un índice de ferritina (log ferritina/receptor soluble de la transferrina)> 2, si están disponibles [8/9]
- •
Punto clave 20. Es poco probable que el contenido de hierro de los alimentos sea suficiente para corregir la anemia y reponer las reservas de hierro en un paciente con anemia ferropénica (AF). [9/9]
- •
Punto clave 21. Siempre que haya una tolerancia adecuada y tiempo suficiente (idealmente, seis a ocho semanas), la administración de sales de hierro oral puede ser útil para el tratamiento preoperatorio de la ferropenia y la AF leve o moderada, así como para reponer las reservas bajas de hierro (fig. 2). [9/9]
- •
Punto clave 22. Las sales de hierro oral deben ser administradas a dosis bajas (40-50mg de hierro elemental) una vez al día, o a dosis moderadas (80-100mg de hierro elemental) en días alternos, para maximizar la absorción y mejorar la tolerancia y la adherencia al tratamiento. [9/9]
- •
Punto clave 23. Tras una cirugía mayor, la liberación de hepcidina inducida por la inflamación asociada a la agresión quirúrgica disminuye drásticamente la absorción de las sales de hierro oral, limitando su biodisponibilidad y aumentando sus efectos adversos gastrointestinales, por lo que generalmente no se recomienda su administración en el posoperatorio inmediato. [9/9]
- •
Punto clave 24. La absorción del hierro sucrosomado® oral es mayoritariamente independiente de la hepcidina y la evidencia disponible sugiere la eficacia de su administración para el tratamiento de la AF y la deficiencia de hierro perioperatorias en distintas cirugías (cardiaca, vascular, ortopédica, bariátrica, ginecológica), pero se necesitan estudios adicionales14. [8/9]
- •
Punto clave 25. Si se confirma la eficacia de la administración de hierro sucrosomado® oral, este podría ser el tratamiento de elección, especialmente en casos de ineficacia/intolerancia a sales de hierro oral, e iniciarse precozmente desde Atención Primaria, lo que podría reducir la prevalencia de anemia y los requerimientos de hierro intravenoso (FeIV) en los días previos a la cirugía electiva. [8/9]
- •
Punto clave 26. El FeIV representa una alternativa segura y eficaz al hierro oral para tratar la ferropenia y la AF perioperatorias15. Debe usarse preferentemente en pacientes anémicos que:
- -
Presenten intolerancia o contraindicación para hierro oral, inflamación, anemia moderada a grave o sangrado persistente.
- -
Tengan una pérdida de sangre perioperatoria prevista de moderada a alta (> 500mL o> 10% de la volemia).
- -
Reciban agentes estimuladores de la eritropoyesis (AEEs)
- -
Dispongan de poco tiempo antes de una cirugía mayor (≤ 4 semanas), o hayan desarrollado anemia posoperatoria moderada o grave. [9/9]
- -
- •
Punto clave 27. El momento de administración, la gravedad de la anemia, la patología subyacente y quizás la formulación de FeIV utilizada (dosis altas vs. dosis bajas), influyen en la respuesta al tratamiento15. [9/9]
- •
Punto clave 28. Aunque son cada vez más seguras, las formulaciones de FeIV son más caras que las de hierro oral y conllevan la necesidad de acceso venoso (pueden producirse efectos adversos en el lugar de la inyección) y monitorización de la infusión (todavía existe el riesgo de reacciones de infusión [relativamente frecuentes] e hipersensibilidad [raras])15. [9/9]
- •
Punto clave 29. Las formulaciones de FeIV que permiten la administración de dosis altas (1.000-1.500mg) en una sola infusión (15-30min), pueden facilitar el tratamiento y ser costo-efectivas15. [9/9]
- •
Punto clave 30. Los AEEs tienen un papel en el tratamiento de la anemia en pacientes quirúrgicos en los que se prevé una pérdida sustancial de sangre, especialmente en aquellos con anemia inflamatoria, en los que se dispone de poco tiempo para la optimización antes la cirugía, y en los que declinan la TCH6,8,11. Se aconseja el tratamiento coadyuvante con hierro IV para aumentar la eficacia de los AEEs y reducir el riesgo de trombocitosis [9/9]
- •
Punto clave 31. Se debe tratar a todos los pacientes con deficiencia documentada de vitamina B12 y/o folatos. La vía (oral o parenteral) y pauta (dosis y frecuencia) de administración dependerán de la causa y gravedad de la deficiencia y de los síntomas asociados. [9/9]
- •
Punto clave 32. La suplementación profiláctica con ácido fólico oral (5mg/día hasta la cirugía) y vitamina B12 parenteral (una dosis de 1mg) podría ser útil para satisfacer las demandas de una actividad eritropoyética aumentada durante el tratamiento de la anemia moderada-grave, especialmente en los pacientes con riesgo de deficiencias de estos factores madurativos y/o que reciben AEEs8. [8/9]
- •
Punto clave 33. La TCH estaría indicada para el tratamiento de la anemia grave, en pacientes con inestabilidad hemodinámica, criterios de riesgo y/o síntomas de alarma. Aunque es una medida útil en estos casos, se trata de un recurso terapéutico limitado, de eficacia transitoria y no exento de complicaciones. [9/9]
- •
Punto clave 34. Una estrategia restrictiva para la TCH (si concentración de hemoglobina <7-8g/dL y/o presencia de signos o síntomas de anemia aguda) es al menos tan efectiva como una estrategia liberal (si Hb <9-10g/dL) en la mayoría de los estudios realizados en pacientes hospitalizados. [9/9]
- •
Punto clave 35. La aplicación de criterios «restrictivos» de TCH ha demostrado su seguridad en la mayoría de las poblaciones estudiadas, excepto en pacientes afectos de isquemia cardiaca aguda o intervenidos de cirugía oncológica abdominal, para los que no se dispone de datos concluyentes. [8/9]
- •
Punto clave 36. En la mayoría de los pacientes hemodinámicamente estables, en los que se considere la TCH, la administración de una sola unidad puede ser una opción válida. Debe recordarse que la transfusión de cada unidad de CH es una decisión clínica independiente, que obliga a revaluar al paciente antes de prescribir la siguiente. [9/9]
El manejo adecuado de la anemia perioperatoria constituye uno de los pilares fundamentales del PBM4,5. Existen documentos de consensos y guías de práctica clínica de elaborados por grupos de trabajo, nacionales e internacionales, y/o Sociedades Científicas que recomiendan un enfoque sistemático del tratamiento de la anemia preoperatoria6–11,13. Respecto a la anemia posoperatoria, la mayoría recomienda el uso de un umbral restrictivo de TCH para el tratamiento de la anemia grave, pero las recomendaciones sobre el tratamiento farmacológico son escasas o inexistentes, lo que favorece la variabilidad en la práctica clínica3,6–11,13.
En base a la evidencia científica y su experiencia clínica, este panel multidisciplinar de profesionales consensuó los aspectos epidemiológicos, etiológicos, diagnósticos y terapéuticos más relevantes relacionados con la anemia perioperatoria y su manejo integral (presentados como PCs). A partir de los 36 PCs consensuados, la mayoría de ellos por unanimidad, se desarrolló una vía clínica pragmática, clara y fácil de seguir a través de algoritmos (figs. 1-3), para el diagnóstico y tratamiento de la anemia perioperatoria y las deficiencias de hematínicos, con el fin de mejorar la evolución clínica y la recuperación funcional del paciente quirúrgico, y hacerlo de forma costo-efectiva5.
Para alcanzar este objetivo, es imprescindible la estrecha colaboración de los principales servicios implicados (cirugía, anestesiología, hematología, medicina interna, medicina de familia) que asegure la continuidad asistencial durante todo el proceso, desde la indicación de la cirugía hasta la recuperación posoperatoria. Además, sería deseable establecer una consulta multidisciplinar de cuidados preoperatorios, como las propuestas por el Centre for Preoperative Care en el Reino Unido (https://cpoc.org.uk) o la Vía Clínica de Recuperación Intensificada en Cirugía del Adulto en España10, para desarrollar un plan de atención personalizado (pre-habilitación) para optimizar, no solo la eritropoyesis, sino el estado global de salud del paciente. Estos cuidados se continuarían durante la cirugía y la recuperación pos-anestésica (cirugía, anestesia), la estancia en la planta de hospitalización (idealmente de manera multidisciplinar, en programas de asistencia compartida: medicina interna, hematología) y tras el alta hospitalaria (medicina de familia).
En síntesis, este documento de consenso no solo analiza por qué, para quién, con qué y cuándo tratar la anemia perioperatoria, sino que además proporciona una vía clínica sobre cómo detectarla, clasificarla y tratarla, en función del tipo de cirugía. Por ello, esperamos que constituya una herramienta útil para el desarrollo y la implementación de programas de identificación precoz y manejo adecuado de la misma, adaptados a los recursos disponibles y las características particulares de las diferentes instituciones hospitalarias de nuestro país.
Presentaciones previasComunicación presentada al 44 Congreso Nacional de la SEMI. Valencia, 15-17 noviembre de 2023. Premio al mejor póster tipo A.
FinanciaciónZambon S.A.U. hizo una aportación económica no condicionada para la coordinación logística del consenso. La concepción, metodología, interpretación de la evidencia existente, elaboración de los puntos clave y del contenido final del consenso se llevó a cabo por los autores. Zambon S.A.U. no ha participado en las reuniones del panel, en la elaboración de los puntos clave ni algoritmos, ni en la versión final de este documento.
Conflicto de interesesManuel Muñoz ha recibido honorarios por conferencias y/o consultorias de Pharmacosmos (Dinamarca), Phamanutra (Italia) y Zambon (España).
Sonsoles Aragón indica que este trabajo fue apoyado por laboratorios Zambon S.A.U a través de un contrato de prestación de servicios a Sonsoles Aragón Alvarez con remuneración económica para la recopilación de datos y análisis de la evidencia científica actual en relación al objetivo del consenso. Los financiadores no tuvieron ningún papel en el diseño del estudio, la recopilación, el análisis o la interpretación de los datos, ni en la redacción del manuscrito.
Mónica Ballesteros ha recibido apoyo para su participación en este trabajo por parte de Zambon S.A.U.
Elvira Bisbe-Vives ha realizado conferencias y cursos para CSL Vifor, CSL Behring, Sysmex y Baxter. El proyecto MAPBM recibe «Unrestricted Grant» a través del centro de investigación del IMIM de CSL Vifor, Baxter y Sysmex.
Carlos Jericó ha recibido honorarios por conferencias, reuniones de consultoría, eventos educativos y soporte para asistencia a reuniones, de Bial, Vifor Pharma y Zambon.
Pilar Llamas-Sillero ha realizado conferencias para AstraZeneca, Boehringer Ingelheim, Bristol-Myers Squibb y Novartis.
Héctor Manuel Meijide-Míguez ha recibido honorarios de Zambon por participar como parte del Comité Asesor de expertos del presente documento de consenso.
Elisabet Rayó-Martin ha colaborado cómo autor del consenso financiado por Zambon.
María José Rodríguez-Suárez ha recibido honorarios de Zambon.
Los autores agradecen a Ampersand Consulting y Zambon S.A.U. el apoyo logístico y técnico prestado para el desarrollo de este documento de consenso. Zambon S.A.U. no ha participado en las reuniones del panel, en la redacción del manuscrito preliminar, ni en la versión final de este documento.