Evaluar si los síntomas/signos de congestión en pacientes con insuficiencia cardíaca aguda (ICA) atendidos en los servicios de urgencias hospitalarios (SUH) permiten predecir la evolución a corto plazo.
Pacientes y métodosPacientes consecutivos diagnosticados de ICA en 45 SUH del registro EAHFE. Recogimos variables clínicas de congestión sistémica (edemas en miembros inferiores, ingurgitación yugular, hepatomegalia) y pulmonar (disnea de esfuerzo, disnea paroxística nocturna, ortopnea y crepitantes pulmonares) analizando su asociación con la mortalidad por cualquier causa a 30 días, de forma cruda y ajustada por diferencias entre grupos.
ResultadosAnalizamos 18.120 pacientes (mediana=83 años, rango intercuartil [RIC]=76-88; mujeres=55,7%). El 44,6% presentaba >3 síntomas/signos congestivos. Individualmente, el riesgo ajustado de muerte a 30 días se incrementó un 14% para la existencia de ingurgitación yugular (hazard ratio [HR]=1,14; intervalo de confianza al 95% [IC 95%]=1,01-1,28) y un 96% para la disnea de esfuerzo (HR=1,96; IC 95%=1,55-2,49). Valorados conjuntamente, el riesgo se incrementó progresivamente con el número de síntomas/signos presentes; así, respecto a los pacientes sin síntomas/signos de congestión, el riesgo incrementó un 109, 123 y 156% en pacientes con 1-2, 3-5 y 6-7 síntomas/signos, respectivamente. Estas asociaciones no mostraron interacción con la disposición final del paciente tras su atención en urgencias (alta/hospitalización), con excepción de edemas en extremidades inferiores, que tuvieron mejor pronóstico en pacientes dados de alta (HR=0,66; IC 95%=0,49-0,89) que en los hospitalizados (HR=1,01; IC 95%=0,65-1,57; p interacción <0,001).
ConclusiónLa presencia de mayor número de síntomas/signos congestivos se asoció a una mayor mortalidad de cualquier causa a los 30 días. Individualmente, la ingurgitación yugular y la disnea de esfuerzo se asocian a mayor mortalidad a corto plazo.
This work aims to assess whether symptoms/signs of congestion in patients with acute heart failure (AHF) evaluated in hospital emergency departments (HED) allows for predicting short-term progress.
Patients and methodsThe study group comprised consecutive patients diagnosed with AHF in 45 HED from EAHFE Registry. We collected clinical variables of systemic congestion (edema in the lower extremities, jugular vein distention, hepatomegaly) and pulmonary congestion (dyspnea on exertion, paroxysmal nocturnal dyspnea, orthopnea, and pulmonary crackles) and analyzed their individual and group association with all-cause 30-day of mortality crudely and adjusted for differences between groups.
ResultsWe analyzed 18,120 patients (median=83 years, interquartile range [IQR]=76-88; women=55.7%). Of them, 44.6% had >3 congestive symptoms/signs. Individually, the 30-day adjusted risk of death increased 14% for jugular vein distention (hazard ratio [HR]=1.14, 95% confidence interval [95% CI]=1.01-1.28) and 96% for dyspnea on exertion (HR=1.96, 95% CI=1.55-2.49). Assessed jointly, the risk progressively increased with the number of symptoms/signs present; compared to patients without symptoms/signs of congestion, the risk increased by 109%, 123%, and 156% in patients with 1-2, 3-5, and 6-7 symptoms/signs, respectively. These associations did not show interaction with the final disposition of the patient after their emergency care (discharge/hospitalization) with the exception of edema in the lower extremities, which had a better prognosis in discharged patients (HR=0.66, 95% CI=0.49 -0.89) than hospitalized patients (HR=1.01, 95% CI=0.65-1.57; interaction p<0.001).
ConclusionThe presence of a greater number of congestive symptoms/signs was associated with greater all-cause 30-day mortality. Individually, jugular vein distention and dyspnea on exertion were associated with higher short-term mortality.
La insuficiencia cardíaca aguda (ICA) es la aparición o el agravamiento de signos y síntomas de insuficiencia cardíaca (IC) que requieren un tratamiento urgente1,2 constituyendo una de las principales causas de morbimortalidad en el mundo. Pese a la variación entre perfiles clínicos y la heterogeneidad de las causas subyacentes, la mayoría de los pacientes con ICA presentan síntomas/signos de congestión pulmonar y sistémica más que de bajo gasto cardíaco.
Diversos estudios, realizados tanto en pacientes con ICA ingresados3 como en los servicios de urgencias hospitalarios (SUH) muestran que la congestión está presente en más del 90% de los casos, independientemente de la fracción de eyección del ventrículo izquierdo4.
Los síntomas/signos de congestión se evalúan fácilmente a pie de cama por el médico precisando de una óptima historia clínica y de una exploración física cuidadosa. Actualmente, la gran cantidad de exploraciones complementarias que permiten fundamentar el diagnóstico clínico (radiología, analítica, ecografía) parece haber desplazado la importancia de esta semiología clínica5,6. Sin embargo, estos parámetros clínicos tienen la ventaja de su fácil obtención. Además, es posible que algunos de estos síntomas/signos de congestión puedan estar asociados con una mala evolución, si bien esto no se ha evaluado particularmente en el paciente atendido en el SUH.
Por ello, el objetivo principal de este estudio fue determinar si los parámetros clínicos de congestión pulmonar y sistémica, analizados individualmente o en conjunto, podían predecir la mortalidad precoz en pacientes con ICA atendidos en el SUH.
MétodoÁmbito del estudioAnálisis secundario del registro Epidemiology of Acute Heart Failure in Emergency departments (EAHFE). Registro multicéntrico, multipropósito, analítico no intervencionista, seguimiento prospectivo incluyendo de forma consecutiva a los pacientes que acuden por episodio de ICA al SUH. Se han realizado 6 fases de reclutamiento (en los años 2007, 2009, 2011, 2014, 2016 y 2018) en un total de 45 SUH españoles. Los detalles y las características de estos pacientes ya se han publicado previamente7–10.
Diseño del estudioIncluimos todos los pacientes del registro EAHFE en los que se habían recogido las siguientes 3 variables clínicas de congestión sistémica: edemas de extremidades inferiores (afectación de ambas extremidades, blandos, que superasen el edema maleolar aislado), ingurgitación yugular (superior a 4cm con el paciente incorporado a 45°) y hepatomegalia (palpación hepática que excede el reborde costal con incremento de la repleción yugular tras su compresión), y las siguientes 4 variables clínicas de congestión pulmonar: disnea de esfuerzo (al menos medianos esfuerzos o superior), ortopnea (empeoramiento de la disnea en decúbito), disnea paroxística nocturna (aparición de disnea rápidamente progresiva tras un cierto tiempo en decúbito) y crepitantes pulmonares (bilateral y al menos en ambos tercios inferiores).
Estas variables fueron de clasificación y se analizaron tanto individualmente como en agrupación (en este caso, el paciente podía presentar entre 0-7 síntomas/signos de congestión).
Variables independientes y de resultadoRecogimos un total de 20 variables independientes: 2 demográficas (edad, sexo), 9 comorbilidades (hipertensión arterial, diabetes mellitus, cardiopatía isquémica, enfermedad renal crónica, enfermedad cerebrovascular, fibrilación auricular, valvulopatía, arteriopatía periférica, enfermedad pulmonar obstructiva crónica), 4 de tratamiento crónico (diuréticos, inhibidores de la enzima convertidora de angiotensina, betabloqueantes, antagonistas de los receptores de aldosterona) y 5 de manejo en urgencias (tratamiento con diurético intravenoso, nitroglicerina endovenosa, inotropos/vasopresores ventilación mecánica no invasiva, necesidad de ingreso hospitalario). Las definiciones de estas variables se presentan en la tabla complementaria (material adicional).
La variable de resultado primario fue la mortalidad por cualquier causa a 30 días tras el evento índice, que se consideró el día de la consulta del paciente en urgencias. La asignación del evento primario fue realizada localmente por el investigador principal mediante contacto telefónico o acceso a las historias clínicas.
Análisis estadísticoSe describieron las variables categóricas mediante frecuencias y porcentajes; las continuas, con la mediana y rango intercuartil (RIC). El análisis de distribución de las variables categóricas se realizó con el test de Chi-cuadrado o test exacto de Fisher, según correspondiera, y el de las continuas, mediante el test de Mann-Whitney.
La magnitud de la asociación entre un determinado síntoma/signo de congestión y la mortalidad a 30 días se expresó como el riesgo proporcional (hazard ratio [HR]) con su intervalo de confianza del 95% (IC 95%), calculado mediante el método de regresión de Cox. Inicialmente, esto se hizo de forma univariable y, posteriormente, se elaboraron 4 modelos de ajuste multivariable: el modelo 1 fue ajustado introduciendo como covariables el resto de síntomas y signos de congestión; el modelo 2 fue ajustado por las mismas covariables que el modelo 1 más edad y sexo; el modelo 3 fue ajustado por las mismas covariables del modelo 2 más comorbilidad (hipertensión arterial, diabetes mellitus, cardiopatía isquémica, insuficiencia renal crónica, enfermedad cerebrovascular, fibrilación auricular, arteriopatía periférica, enfermedad pulmonar obstructiva crónica) y tratamiento de base (diuréticos, inhibidores del eje renina-angiotensina, beta-bloqueantes y antagonistas de los receptores de mineralocorticoides); y el modelo 4 fue ajustado por las mismas covariables del modelo 3 más el manejo durante el episodio de descompensación (diuréticos, vasodilatadores e inotropos/vasopresores endovenosos, ventilación no invasiva y hospitalización; modelo con ajuste total). En el modelo con ajuste total, se analizó la existencia de interacción entre síntoma/signo y el hecho que el paciente hubiese sido hospitalizado o dado de alta directamente desde urgencias.
Todos los análisis de mortalidad mencionados se repitieron formando 4 grupos en función del número de síntomas/signos que presentase el paciente (0, 1-2, 3-5 y 6-7) y se tomó el grupo sin congestión (0) como referencia.
En todas las comparaciones, se aceptó que las diferencias eran estadísticamente significativas si el valor de p era inferior a 0,05, o si el IC 95% de la HR excluía el valor 1. El análisis estadístico se realizó con el programa SPSS® versión 24.0 para Windows (IBM Corp. Released 2016. IBM SPSS Statistics for Windows, Version 24.0. Armonk, NY: IBM Corp).
Aspectos éticosSe siguieron los principios éticos de la Declaración de Helsinki sobre investigación en humanos, y se solicitó el consentimiento informado a todos los pacientes para participar en el estudio.
El protocolo fue aprobado por el Comité de Ética e Investigación Clínica del Hospital Universitario Central de Asturias como comité principal (protocolos 49/2010, 69/2011, 166/13, 160/15 y 205/17) y por los del resto de centros participantes.
ResultadosDe los 18.370 pacientes incluidos en el registro EAHFE, en 18.120 (98,6%) se recogieron síntomas/signos de congestión sujetos a investigación, constituyendo la población de estudio. Más de la mitad fueron mujeres con mediana de edad de 83 (RIC=76-88). El resto de características clínicas de los pacientes del estudio se presenta en la tabla 1.
Características de los 18.120 pacientes incluidos en el presente estudio
| Todos los pacientesN=18.120 n (%) | Valores perdidosn (%) | |
|---|---|---|
| Datos epidemiológicos | ||
| Edad (mediana [RIC]) | 83 (76-88) | 22 (0,1) |
| Sexo femenino | 10.059 (55,7) | 54 (0,3) |
| Comorbilidades | ||
| Hipertensión arterial | 15.130 (83,8) | 58 (0,3) |
| Fibrilación auricular | 8.987 (49,8) | 59 (0,3) |
| Diabetes mellitus | 7.530 (41,7) | 59 (0,3) |
| Cardiopatía isquémica | 5.020 (27,8) | 60 (0,3) |
| Enfermedad renal crónica (creatinina >2mg/dL) | 4.919 (27,2) | 57 (0,3) |
| Valvulopatía cardíaca | 4.671 (25,9) | 61 (0,3) |
| Enfermedad pulmonar obstructiva crónica | 4.268 (23.6) | 70 (0,4) |
| Enfermedad cerebrovascular | 2.284 (12,6) | 59 (0,3) |
| Enfermedad arterial periférica | 1.654 (9,2) | 64 (0,4) |
| Tratamiento crónico en domicilio | ||
| Diuréticos | 13.234 (75,0) | 470 (2,6) |
| Inhibidores del sistema renina-angiotensina | 9.857 (55,9) | 500 (2,8) |
| Beta-bloqueante | 7.713 (43,8) | 517 (2,9) |
| Antagonistas de los receptores mineralocorticoides | 2.843 (16,1) | 497 (2,7) |
| Manejo en urgencias durante la descompensación | ||
| Diuréticos iv | 15.361 (86,4) | 339 (1,9) |
| Vasodilatadores iv | 2.263 (12,7) | 348 (1,9) |
| Inotropos/vasopresores iv mórficos sc/iv | 276 (1,6) | 359 (2,0) |
| Ventilación mecánica no invasiva | 1.224 (6,9) | 344 (1,9) |
| Ingreso hospitalario | 13.584 (75,0) | 10 (0,1) |
iv: intravenosa; RIC: rango intercuartil; sc: subcutánea.
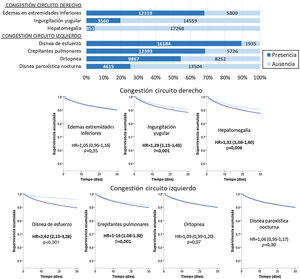
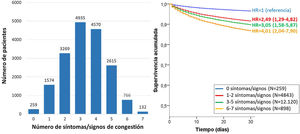
El síntoma/signo más frecuente de congestión sistémica fue el edema en extremidades inferiores, que se observó en 12.319 pacientes, y el más frecuente de congestión pulmonar fue la disnea de esfuerzo, presente en 16.184 pacientes (fig. 1). El 98,6% presentaba al menos un síntoma/signo de congestión, y el 44,6% presentaba 4 o más (fig. 2).
En 18.119 pacientes se pudo realizar el seguimiento (un paciente perdido) y 1.781 fallecieron durante los 30 días siguientes a la atención en el SUH. La mortalidad acumulada de la serie fue del 9,9% (IC 95%=9,5-10,3). En el análisis univariable, se observó una asociación estadísticamente significativa de la mortalidad a 30 días de la presencia de ingurgitación yugular, hepatomegalia, disnea de esfuerzo y crepitantes pulmonares, pero no con los edemas en extremidades inferiores, ortopnea y disnea paroxística nocturna (fig. 1).
Además, se observó un incremento progresivo en el riesgo de morir a 30 días a medida que se incrementaba el número de síntomas/signos de congestión, y alcanzaba una HR de 4,01 (IC 95%=2,04-7,90) en los pacientes con 6-7 síntomas/signos (fig. 2). En relación a los pacientes sin síntomas y signos clínicos de congestión, la mortalidad a 30 días en los pacientes que mostraban sintomatología de congestión exclusivamente sistémica estaba incrementada (HR=2,40; IC 95%=1,09-5,27), así como también lo estaba en los pacientes con congestión exclusivamente izquierda (HR=2,77; IC 95%=1,43-5,36) o en los que existía sintomatología de congestión en ambos territorios (HR=3,00; IC 95%=1,56-5,77).
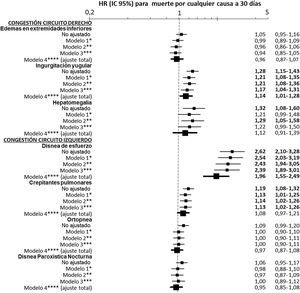
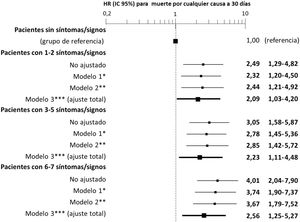
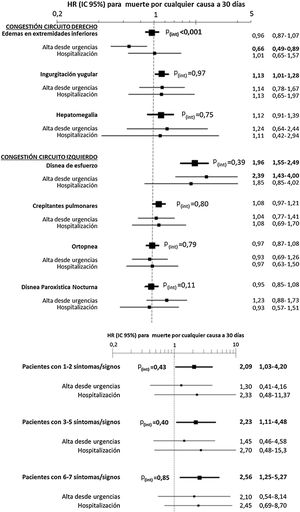
El análisis multivariable mostró riesgos consistentes en los diferentes modelos, similares a los del análisis no ajustado, aunque con tendencia a disminuir la magnitud de las asociaciones (figs. 3 y 4). En el modelo con ajuste total, la presencia de ingurgitación yugular incrementó el riesgo de muerte por cualquier causa a 30 días en un 14% (HR=1,14; IC 95%=1,01-1,28) y la disnea de esfuerzo un 96% (HR=1,96; IC 95%=1,55-2,49) (fig. 3). Comparado con la ausencia de congestión, la presencia de 1-2 síntomas/signos aumentó el riesgo en un 109%; 3-5 síntomas/signos simultáneos en un 123%, y 6-7 en un 156% (fig. 4). El análisis de interacción entre la presencia de congestión y la disposición final del paciente tras la atención en urgencias no mostró ninguna interacción significativa con excepción de los edemas en extremidades inferiores, que se asoció a mejor pronóstico en los pacientes dados de alta desde urgencias (HR=0,66; IC 95%=0,49-0,89) que en los hospitalizados (HR=1,01; IC 95%=0,65-1,57; p interacción <0,001) (fig. 5).
Modelos de ajuste multivariable para la asociación de los diferentes síntomas y signos de congestión evaluados individualmente con la mortalidad por cualquier causa a 30 días.
Las hazard ratio (HR) en negrita denotan significación estadística (p<0,05).
*El Modelo 1 fue ajustado introduciendo como covariables el resto de síntomas y signos de congestión.
**El Modelo 2 fue ajustado por las mismas covariables que el Modelo 1 más edad y sexo.
***El Modelo 3 fue ajustado por las mismas covariables del Modelo 2 más comorbilidad (hipertensión arterial, diabetes mellitus, cardiopatía isquémica, insuficiencia renal crónica, enfermedad cerebrovascular, fibrilación auricular, arteriopatía periférica, enfermedad pulmonar obstructiva crónica) y tratamiento de base (diuréticos, inhibidores del eje renina-angiotensina, beta-bloqueantes y antagonistas de los receptores de mineralocorticoides).
****El Modelo 4 fue ajustado por las mismas covariables del Modelo 3 más el manejo durante el episodio de descompensación (diuréticos, vasodilatadores e inotropos/vasopresores endovenosos, ventilación no invasiva y hospitalización).
Modelos de ajuste multivariable para la asociación entre el número de síntomas y signos de congestión que presenta el paciente y la mortalidad por cualquier causa a 30 días.
Las hazard ratio (HR) en negrita denotan significación estadística (p<0,05).
*El Modelo 1 fue ajustado introduciendo como covariables edad y sexo.
**El Modelo 2 fue ajustado por las mismas covariables del Modelo 1 más comorbilidad (hipertensión arterial, diabetes mellitus, cardiopatía isquémica, insuficiencia renal crónica, enfermedad cerebrovascular, fibrilación auricular, arteriopatía periférica, enfermedad pulmonar obstructiva crónica) y tratamiento de base (diuréticos, inhibidores del eje renina-angiotensina, beta-bloqueantes y antagonistas de los receptores de mineralocorticoides)
***El Modelo 3 fue ajustado por las mismas covariables del Modelo 2 más el manejo durante el episodio de descompensación (diuréticos, vasodilatadores e inotropos/vasopresores endovenosos, ventilación no invasiva y hospitalización).
Evaluación en el modelo multivariable con ajuste total* que evalúa la mortalidad por cualquier causa a 30 días de la interacción entre los síntomas y signos de congestión tomados individualmente (superior) o agrupados (inferior) y la disposición del paciente tras finalizar la atención en urgencias (alta/ingreso).
Las hazard ratio (HR) en negrita denotan significación estadística (p<0,05).
*El ajuste total se llevó a cabo introduciendo como covariables el resto de síntomas y signos de congestión (en el caso del análisis de síntomas y signos individualizados —arriba—, no en el análisis agrupado —abajo—), edad y sexo, comorbilidad (hipertensión arterial, diabetes mellitus, cardiopatía isquémica, insuficiencia renal crónica, enfermedad cerebrovascular, fibrilación auricular, arteriopatía periférica, enfermedad pulmonar obstructiva crónica), tratamiento de base (diuréticos, inhibidores del eje renina-angiotensina, beta-bloqueantes y antagonistas de los receptores de mineralocorticoides) y manejo durante el episodio de descompensación (diuréticos, vasodilatadores e inotropos/vasopresores endovenosos, ventilación no invasiva y hospitalización).
Los principales hallazgos de este estudio son 3. El primero, los signos de congestión en el momento de la consulta de los pacientes con ICA son muy frecuentes y su ausencia excepcional pues se observa en solo el 1% de pacientes atendidos en urgencias. El segundo es que, individualmente, algunos de ellos se asocian con la mortalidad a corto plazo y a medida que incrementan en número el riesgo de fallecer aumenta. Y el tercero, la asociación entre la presencia de síntomas/signos de congestión con la mortalidad observada en los pacientes dados de alta desde urgencias es similar a la evidenciada si el paciente es hospitalizado. La excepción son los edemas en extremidades inferiores, cuya presencia en los pacientes dados de alta se asociaría a un mejor pronóstico con alta desde urgencias que desde hospitalización.
Todos estos hallazgos se han obtenido analizando una cohorte de más de 18.000 pacientes diagnosticados de ICA en urgencias, que globalmente presentaban una edad muy avanzada (mediana 83 años), mucha comorbilidad y cuya mortalidad a 30 días (del 9,9%) está dentro del rango se reportan otras series similares3,11,12.
En pacientes con ICA en los SUH, los síntomas/signos de congestión tanto pulmonar como sistémica suelen ser los más frecuentes. En el registro europeo ESC-EORP-HFA (Heart Failure Long-Term Registry), que incluyó 7.865 pacientes con ICA, el 89,7% tenían signos clínicos de congestión a su ingreso3. Se han reportado resultados similares en España, con 11.261 pacientes con ICA, donde el 93,1% presentaron signos/síntomas de congestión en su atención en los SUH4.
En el presente estudio hasta el 98,6% de pacientes muestran algún síntoma/signo congestivo en urgencias y el 89,9% muestran más de un síntoma/signo, y es posible que en los estudios previamente mencionados no se realizase una búsqueda específica en el momento de la atención en urgencias de toda la semiología de congestión en los pacientes con ICA y aquellos pudiesen incluir algunos casos paucisintomáticos con algún síntoma aislado que pasase desapercibido.
Son escasos los estudios que correlacionan el número de síntomas/signos con el pronóstico del paciente13–17. En nuestro estudio la presencia de un mayor número de síntomas/signos se asoció a mayor mortalidad de cualquier causa a los 30 días. En un estudio reciente que incluyó 24.724 pacientes del registro OPTIMIZE-HF, y en el cual se aplicó una escala de congestión utilizando diferentes síntomas/signos (disnea, ortopnea, fatigabilidad, presión venosa yugular [PVY], crepitantes y edemas), los pacientes se dividieron en 3 grupos (bajo, moderado o elevado grado) y se evidenció que el grupo con mayor número de síntomas/signos tenía una mortalidad posalta (a los 90-180-365 días, respectivamente) mayor que los otros dos grupos18.
De forma individual, en nuestro estudio se evidencia una asociación entre la ingurgitación yugular y la disnea de esfuerzo con la mortalidad a los 30 días por cualquier causa. En un estudio de 2.569 pacientes con IC se evaluó si la PVY era un factor pronóstico independiente, concluyendo que se asociaba a un mayor riesgo de muerte y hospitalización por IC (RR=1,30; IC 95%=1,11-1,53; p<0,005)13. Aunque su medida en ocasiones está limitada por diferentes factores (obesidad o enfermedades pulmonares), la presencia de ingurgitación yugular se postula como uno de los signos más útiles para ayudar a establecer el pronóstico en la ICA15,17. Como esperaríamos, la disnea de esfuerzo constituye el síntoma persistente más común al alta hospitalaria y su alivio o mejora tiene un impacto en el pronóstico ya que traduce el grado de resolución de la congestión19,20.
También se ha demostrado que la capacidad funcional por sí misma predice la mortalidad y las hospitalizaciones en pacientes con IC21. Este resultado puede sugerir que la disnea de esfuerzo traduce una IC probablemente más crónica y asociada a un peor pronóstico. La ausencia de disnea de esfuerzo fue muy infrecuente y podría traducir casos de ICA con causa2. En cualquier caso, creemos que esta fuerte asociación del síntoma «empeoramiento de la disnea» con la mortalidad a 30 días pone en valor la importancia de la percepción del paciente respecto a la gravedad del episodio, que el paciente lo asocia fundamentalmente al empeoramiento de su clase funcional. El hecho de que este sea un síntoma (subjetivo, pues) subraya sobremanera la importancia de la historia clínica y de tomar en gran consideración el relato que hace el propio paciente.
No hemos encontrado diferencias con los distintos síntomas/signos de congestión con la mortalidad entre los pacientes dados de alta directamente desde urgencias frente a los hospitalizados, excepto que la presencia de los edemas en los dados de alta se asociaría a un mejor pronóstico, por lo que, junto con otras variables, se decide qué pacientes pueden darse de alta directa de una forma apropiada. Hasta un 40% son dados de alta con síntomas/signos de congestión y se ha relacionado con un alto índice de eventos adversos posalta22. Este grupo representaría un perfil clínico diferente con una mínima congestión residual a su alta, presiones arteriales normales o elevadas, bajos índices de comorbilidad general o cardíaca, y formas no avanzadas y mejor clase funcional23–26.
LimitacionesLos síntomas/signos evaluados en este estudio para medir la congestión, en ocasiones pueden ser secundarios a enfermedades no cardíacas y tener escasa sensibilidad para determinar la congestión. Por esto, el diagnóstico de inclusión en el registro EAHFE es por criterios clínicos, si bien en un porcentaje cercano al 90%, el diagnóstico está confirmado por el estudio de péptidos natriuréticos y/o por ecocardiografía. En segundo lugar, la determinación de cada síntoma/signo la realizó un único investigador asistencial sin confirmación del comité central de adjudicación independiente y está sujeta a la variación interobservador (particularmente la PVY). La tercera limitación es que no se determinaron los parámetros clínicos de perfusión, la cual se ha visto relacionada con una mayor mortalidad. Cuarto, aunque pudo haber cierto sesgo de selección al incluir solamente a los pacientes en los que se habían recogido los síntomas/signos motivo de estudio, consideramos que este fue escaso, ya que estos datos solo estaban ausentes en el 1,4% de la cohorte EAHFE. Finalmente, no se consignó el estado de congestión al alta, tras la respuesta al tratamiento depletivo. Si bien en los pacientes con alta directa desde urgencias su situación congestiva pudo no haber variado mucho, es esperable que en el caso de los hospitalizados sí haya habido cambios.
ConclusiónLos parámetros clínicos de congestión determinados en cualquier nivel asistencial en los pacientes con ICA, analizados en conjunto, pueden predecir la evolución de la ICA. La presencia de un mayor número de síntomas/signos de congestión se asoció a un incremento de la mortalidad a corto plazo. La ingurgitación yugular y la disnea de esfuerzo fueron los que se asociaron a una mayor mortalidad. Tener en cuenta su presencia podría mejorar el manejo y pronóstico del paciente y guiar hacia una terapia individual.
FinanciaciónEste trabajo fue posible en parte gracias a las ayudas del Instituto de Salud Carlos III con fondos del Ministerio de Sanidad y FEDER (PI15/01019, PI18/00393), La Marató de TV3 (2015/2510) y la Generalitat de Cataluña para grupos de investigación consolidados (GRC 2009/1385, 2014/0313, 2017/1424).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Marta Fuentes, Cristina Gil (H.U. de Salamanca); Héctor Alonso, Enrique Pérez-Llantada (H. Marqués de Valdecilla de Santander); Francisco Javier Martín-Sánchez, Guillermo Llopis García, Mar Suárez Cadenas (H. Clínico San Carlos de Madrid); Òscar Miró, Víctor Gil, Rosa Escoda, Sira Aguiló, Carolina Sánchez, Ana García-Álvarez (H. Clínic de Barcelona); Javier Millán (H.U. i Politécnic La Fe de Valencia); José Pavón (H. Dr. Negrín de Las Palmas de Gran Canaria); Antonio Noval (H. Insular de Las Palmas de Gran Canaria); María Luisa López-Grima, Amparo Valero, María Ángeles Juan (H. Dr. Peset de Valencia); Alfons Aguirre, María Angels Pedragosa, Silvia Mínguez Masó (H. del Mar de Barcelona); María Isabel Alonso, Francisco Ruiz (H. de Valme de Sevilla); José Miguel Franco (H. Miguel Servet de Zaragoza); Ana Belén Mecina (H. de Alcorcón de Madrid); Josep Tost, Marta Berenguer, Ruxandra Donea (Consorci Sanitari de Terrassa); Susana Sánchez Ramón, Virginia Carbajosa Rodríguez (H.U. Río Hortega de Valladolid); Pascual Piñera, José Andrés Sánchez Nicolás (H. Reina Sofía de Murcia); Raquel Torres Garate (H. Severo Ochoa de Madrid); Aitor Alquézar-Arbé, Miguel Alberto Rizzi, Sergio Herrera (H. de la Santa Creu y Sant Pau de Barcelona); Javier Jacob, Alex Roset, Irene Cabello, Antonio Haro (H.U. de Bellvitge de Barcelona); Fernando Richard, José María Álvarez Pérez, María Pilar López Diez (H.U. de Burgos); Pablo Herrero Puente, Joaquín Vázquez Álvarez, Belén Prieto García, María García García, Marta Sánchez González (H.U. Central de Asturias de Oviedo); Pere Llorens, Patricia Javaloyes, Inmaculada Jiménez, Néstor Hernández, Begoña Espinosa, Adriana Gil, Francisca Molina, Tamara García (H. General de Alicante); Juan Antonio Andueza (Hospital General Universitario Gregorio Marañón de Madrid); Rodolfo Romero (H.U. de Getafe de Madrid); Martín Ruíz, Roberto Calvache (H. de Henares de Madrid); María Teresa Lorca Serralta, Luis Ernesto Calderón Jave (H. del Tajo de Madrid); Beatriz Amores Arriaga, Beatriz Sierra Bergua (H. Clínico Lozano Blesa de Zaragoza); Enrique Martín Mojarro, Brigitte Silvana Alarcón Jiménez (H. Sant Pau i Santa Tecla de Tarragona); Lisette Travería Bécquer, Guillermo Burillo (H.U. de Canarias de Tenerife); Lluís Llauger García, Gerard Corominas LaSalle (H.U. de Vic, Barcelona); Carmen Agüera Urbano, Ana Belén García Soto, Elisa Delgado Padial (H. Costa del Sol de Marbella, Málaga); Ester Soy Ferrer, María Adroher Múñoz (H. Josep Trueta de Girona); José Manuel Garrido (H. Virgen Macarena de Sevilla); Francisco Javier Lucas-Imbernón (H. General Universitario de Albacete); Rut Gaya (H. Juan XXIII de Tarragona); Carlos Bibiano, María Mir, Beatriz Rodríguez (H. Infanta Leonor de Madrid); José Luis Carballo (Complejo Hospitalario Universitario de Ourense); Esther Rodríguez-Adrada, Belén Rodríguez Miranda, Monika Vicente Martín (H. Rey Juan Carlos de Móstoles, Madrid) y Pere Coma Casanova, Joan Espinach Alvarós (H. San Joan de Deu de Martorell, Barcelona).