Estudiar la prevalencia de anticuerpos neutralizantes en el personal sanitario y de apoyo tras la administración de la segunda dosis de vacuna BNT162b2 (Pfizer–BioNTech).
Material y métodosEn diciembre 2021 llevamos a cabo un estudio en el Departamento de Salud de Orihuela, Alicante (España), formado por 1.500 trabajadores. En los participantes del estudio, recogimos variables demográficas y realizamos un test «point-of-care» (POC) de inmunocromatografía para medir la presencia de anticuerpos neutralizantes (OJABIO® SARS-CoV-2 Neutralizing Antibody Detection Kit, fabricado por Wenzhou OJA Biotechnology Co., Ltd.- Wenzhou, Zhejiang, China) antes de la administración de la tercera dosis de vacuna.
ResultadosObtuvimos información completa de 964 (64%) trabajadores, siendo 290 varones y 674 mujeres. La edad media fue de 45,8 años (mín: 18, máx: 68) y el tiempo desde la última dosis (TUD) de vacuna fue 40,5 semanas (mín: 1,71; máx: 47,71). Un total de 131 (13,5%) habían padecido infección por SARS-CoV-2 confirmada mediante RT-PCR. La proporción de sujetos con presencia de anticuerpos neutralizantes fue de 38,5%. En el análisis multivariable el TUD de vacuna (razón de probabilidades ajustada [ORa] semana: 1,07; IC 95%: 1,04; 1,09) y la infección previa por SARS-CoV-2 (ORa: 3,7; IC 95%: 2,39; 5,63) mostraron asociación estadísticamente significativa con la presencia de anticuerpos neutralizantes.
ConclusionesEl TUD de vacuna y la infección previa por SARS-CoV-2 determinaron la presencia de anticuerpos neutralizantes en 38,5% del personal sanitario y personal de apoyo.
To study the prevalence of neutralizing antibodies in healthcare workers and healthcare support personnel after the administration of the second dose of the BNT162b2 vaccine (Pfizer-BioNTech).
Materials and methodsIn December 2021, we undertook a study in the Health Department in Orihuela, Alicante (Spain), which consists of 1500 workers. We collected demographic variables about the study participants, and we performed a «point-of-care» immunochromatography test to measure the presence of neutralizing antibodies (OJABIO® SARS-CoV-2 Neutralizing Antibody Detection Kit, manufactured by Wenzhou OJA Biotechnology Co., Ltd. Wenzhou, Zhejiang, China) before the administration of the third dose of the vaccine.
ResultsWe obtained complete information about 964 (64%) workers, which consisted of 290 men and 674 women. The average age was 45,8 years (min. 18, max. 68) and the average time since the last dose of the vaccine was 40,5 weeks (min. 1,71, max. 47,71). A total of 131 participants (13,5%) had suffered infection by SARS-CoV-2 confirmed using RT-PCR. The proportion of participants who showed presence of neutralizing antibodies was 38,5%. In the multivariable analysis, the time since the last dose of the vaccine (aOR week: 1,07; 95%CI: 1,04; 1,09) and previous infection by SARS-CoV-2 (aOR: 3,7; 95CI: 2,39; 5,63) showed a statistically significant association with the presence of neutralizing antibodies.
ConclusionsThe time since the administration of the last dose of the vaccine and the previous infection by SARS-CoV-2 determined the presence of neutralizing antibodies in 38,5% of the healthcare workers and support workers.
La vacuna contra el virus SARS-CoV-2 (severe acute respiratory syndrome coronavirus 2) ha sido una de las principales herramientas de prevención frente a la enfermedad por COVID-191. En España, durante el mes de diciembre del año 2020 se realizaron campañas de vacunación masiva contra el SARS-CoV-2. Los profesionales sanitarios y personal de soporte sanitario fueron considerados colectivos de primera línea frente a la pandemia COVID-19 e incluidos en el grupo de riesgo prioritario a tener en cuenta en las estrategias de vacunación. La principal vacuna utilizada para este colectivo fue la BNT162b2 (Pfizer–BioNTech)2. Los datos reportados para esta vacuna por algunos ensayos clínicos y estudios «real-world»3,4 han resultado de una alta eficacia (94-95%) contra casos sintomáticos de moderada a grave enfermedad tras la administración de la segunda dosis3–6.
Aunque la eficacia de la vacuna frente al SARS-CoV-2ha sido ampliamente demostrada mediante múltiples estudios alcanzando tasas de protección de hasta 95% después de la segunda dosis3,4 parece que la durabilidad de la protección inmunológica a largo plazo es limitada. Algunos estudios reportan una disminución en la eficacia vacunal relacionada con aumento en la hospitalización y muerte superior a las 20 semanas tras la vacunación de dos dosis de vacuna ChAdOx1-S o BNT162b25–7. Además, también se ha asociado con una disminución de los títulos de anticuerpos neutralizantes anti-SARS-CoV-28–10.
La variante B.1.617.2 (delta) se convirtió en la variante predominante a partir de agosto de 2021, con frecuencias de secuenciación por PCR entre 50-100%11. Durante este periodo, se observó un aumento en la incidencia de infección por SARS-CoV-2 y también una disminución de la cobertura vacunal. Ambos aspectos en conjunto cuestionaron la eficacia de las vacunas comercializadas frente a variantes emergentes12,13. No obstante, las vacunas basadas en diseño con ARNm han mostrado ser seguras y eficacias contra infecciones severas, hospitalización y muerte causadas por diferentes variantes del SARS-CoV-2 incluyendo la variante delta14. Aun así, queda por esclarecer aspectos relacionados con la inmunogenicidad asociada a la actividad neutralizante de los anticuerpos generados15 y son necesarios estudios adicionales para evaluar esta actividad a largo plazo.
Con el fin de conocer las dimensiones de propagación del SARS-CoV-2 y el estado inmunológico poblacional, así como promover la contención y mitigación de la pandemia por COVID-19, han sido implementadas una amplia variedad de herramientas diagnósticas16–18. Respecto a las técnicas utilizadas para el análisis serológico, las pruebas basadas en inmunocromatografía de flujo lateral (LFIC) han mostrado ser una herramienta capaz de detectar anticuerpos anti-SARS-CoV-2, como los anticuerpos anti-proteína «S», de una forma rápida, práctica y accesible económicamente17,18.
Los anticuerpos IgG frente a la proteína S o «Spike» del SARS-CoV-2 (fragmento receptor binding domain [RBD]) han mostrado una buena correlación con el título de anticuerpos neutralizantes anti-SARS-CoV-29,17. La proteína S es la diana antigénica de la mayoría de las vacunas debido a que actúa como vía de entrada celular del virus. La evolución mutacional de esta proteína en las diferentes variantes emergentes del SARS-CoV-2 pone en compromiso la capacidad neutralizante de los anticuerpos generados pos-vacunación siendo así necesario reevaluar y rediseñar las vacunas comercializadas18,19.
Por tanto, actualmente, la enfermedad por COVID-19 continúa siendo un desafío. La necesidad de estrategias de prevención y diagnóstico siguen siendo necesarias para evitar un repunte del SARS-CoV-2. Los LFIC además de ser pruebas más económicas y rápidas (∼15 minutos) que otros ensayos serológicos de rutina, probados y validados como ensayos eficaces para detectar anticuerpos neutralizantes anti-SARS-CoV-217,20–22, también permite emplearlas en zonas descentralizadas para así estimar la prevalencia de anticuerpos frente a COVID-19 en diferentes colectivos.
La disminución de la inmunidad protectora contra la COVID-19 impulsó una tercera ronda de vacunación con dosis de refuerzo en todo el mundo. En España, la campaña de refuerzo se inició en enero de 2022 para el sector sanitario con una tercera dosis de la vacuna BNT162b2 (Pfizer-BioNTech)23.
El objetivo de nuestro estudio es estimar la prevalencia y durabilidad de anticuerpos neutralizantes anti-SARS-CoV-2 inducidos tras segunda dosis de vacuna BNT162b2 (Pfizer-BioNTech) en el personal sanitario y personal sanitario de apoyo mediante un ensayo rápido basado en LFIC.
MétodosDiseño y criterios de selecciónSe llevó a cabo un estudio descriptivo y transversal realizado en el departamento de Salud de Orihuela (Alicante, España). Este departamento está formado por 1.500 trabajadores. En España, la vacunación es de libre elección por tanto la participación en nuestro estudio fue voluntaria. Se propuso participar en el estudio a todo el personal sanitario y de apoyo sanitario previamente a la administración de la dosis de refuerzo o tercera dosis de vacuna frente al SARS-CoV-2. El estudio se llevó a cabo en el centro de vacunación durante el mes de diciembre de 2021.
El equipo investigador proporcionó toda la información relevante del estudio a cada sujeto y obtuvo el consentimiento informado previamente al inicio del procedimiento de estudio. Las variables demográficas fueron obtenidas mediante un cuestionario anónimo, estandarizado en formato papel distribuido antes de realizar el test serológico LFIC y previamente a la vacunación de la dosis de refuerzo.
Test serológicoPara evaluar la presencia de anticuerpos neutralizantes empleamos el test rápido serológico OJABIO® SARS-CoV-2 Neutralizing Antibody Detection Kit (Colloidal 109 Gold Method) fabricado por Wenzhou OJA Biotechnology Co., Ltd. (Wenzhou, Zhejiang, China). Se trata de un ensayo de detección de anticuerpos «point-of-care» (POC) basado la técnica de LFIC.
El test fue realizado siguiendo las recomendaciones del fabricante, usando únicamente los reactivos y material proporcionado por el kit. La interpretación del resultado fue llevada a cabo por investigadores entrenados.
Los anticuerpos neutralizantes contra el SARS-CoV-2 presentes en la muestra se unen a la proteína «Spike» SARS-CoV-2 conjugada con una partícula de oro coloidal. El producto conjugado resultante migra hacia la matriz de reacción arrastrado por la acción del flujo laminar. A continuación, una vez en la plataforma de reacción son capturados por anticuerpos anti-Inmunoglobulina (IgG o IgM) fijados al soporte de nitrocelulosa. La unión del complejo a la membrana se revela mediante la formación de una banda T que indica la presencia de anticuerpos neutralizantes contra el SARS-CoV-2. La línea contigua C indica la correcta realización técnica de la prueba. Se considera positiva la presencia de dos bandas visibles: C (control) y T (anticuerpos totales). La presencia única de la banda C se interpreta como un resultado negativo. Todas las pruebas con ausencia de las bandas C y T fueron invalidadas.
Este test de LFIC de OJABIO® fue validado en un estudio previo realizado por la Universidad de Alicante22 frente a un ensayo de neutralización viral basado en el ensayo Enzyme-Linked ImmunoSorbent Assay (ELISA) sustitutivo (sVNT) en 78 casos y 39 controles, dando como resultado una especificidad para la prueba OJABIO® de 1,00 (IC 95%: 0,91-1,00) y una sensibilidad de 0,99 (IC 95%: 0,93-1,00).
Variables y análisis estadísticoLas variables demográficas recopiladas fueron: edad (en años) y sexo. Además, se recogieron las siguientes variables epidemiológicas y clínicas: infección previa por SARS-CoV-2 (definida como prueba PCR positiva), tiempo desde la última dosis (TUD) (definido como semanas desde la vacuna, última dosis hasta la prueba del estudio, o desde una PCR positiva para SARS-CoV-2 hasta la prueba del estudio), padecer enfermedad crónica, haber superado una infección reciente (último mes) y vacuna administrada con fechas y número de dosis anteriores. El análisis estadístico se realizó mediante cálculo de odds ratio (OR) para cada variable cualitativa. Para las variables cuantitativas, se utilizó regresión logística para el cálculo de OR. Para la edad se utilizaron periodos de 10 años. Para calcular la razón de probabilidades ajustada (ORa) se realizó un modelo multivariante de regresión logística por pasos usando todas las variables mencionadas anteriormente. Se calcularon intervalos de confianza (IC) del 95%. Los valores de p inferiores a 0,05 se consideraron estadísticamente significativos. Los datos se analizaron utilizando el software estadístico SPSS 23.0 (IBM SPSS Statistics for Windows, versión 23.0 [IBM Corp., Armonk, N.Y., EE. UU.]).
Aspectos éticosEl estudio fue realizado de acuerdo con la Declaración de Helsinki relacionada con los ensayos clínicos en humanos. La propuesta de investigación fue aprobada por el Comité Ético de Investigación de la Universidad de Alicante (España) (archivo UA-2021-05-07_5, con fecha 24/05/2021), y el Comité Ético de Investigación Clínica del Departamento de Salud de Orihuela (España) (MC-2021-023, con fecha 15/11/2021).
ResultadosEl Departamento de Salud de Orihuela está formado por 1.500 trabajadores sanitarios y de apoyo sanitario. De ellos, 1.352 participaron en el estudio y 977 respondieron a la encuesta. Entre los encuestados, 13 sujetos fueron excluidos por tener la encuesta epidemiológica incompleta. Obtuvimos una tasa de contacto de 90,1% (1.352/1.500), una tasa de respuesta de 72,3% (977/1.352) y una tasa de elegibilidad de 98,7% (964/977)24.
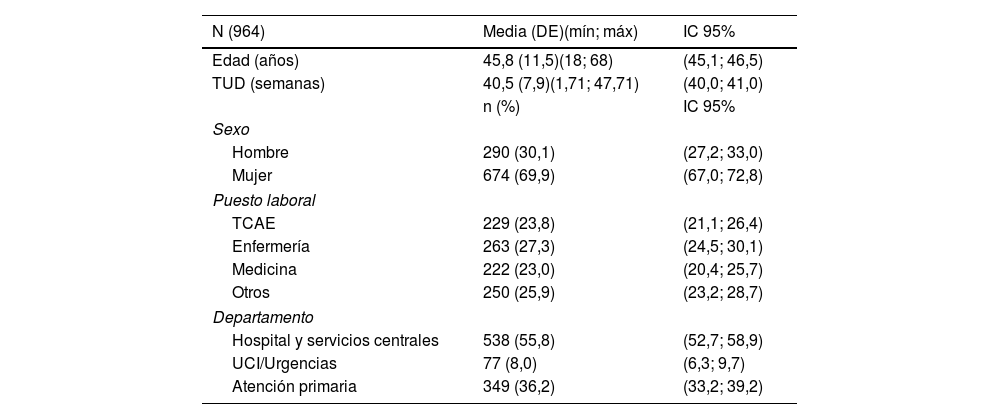
De todos ellos, 674 (69,9%) eran mujeres (la proporción hombre-mujer fue de 0,43) y la edad media (± DE) fue de 45,8 ±11,5 años; 23,8% eran técnicos en cuidados auxiliares de enfermería (TCAE), 27,3% enfermería y 23% médicos. Más de 55% formaban parte de unidades de sala de Hospital y servicios centrales.
En la tabla 1 se muestra la distribución de la población según datos demográficos y puesto laboral.
Características sociodemográficas
| N (964) | Media (DE)(mín; máx) | IC 95% |
|---|---|---|
| Edad (años) | 45,8 (11,5)(18; 68) | (45,1; 46,5) |
| TUD (semanas) | 40,5 (7,9)(1,71; 47,71) | (40,0; 41,0) |
| n (%) | IC 95% | |
| Sexo | ||
| Hombre | 290 (30,1) | (27,2; 33,0) |
| Mujer | 674 (69,9) | (67,0; 72,8) |
| Puesto laboral | ||
| TCAE | 229 (23,8) | (21,1; 26,4) |
| Enfermería | 263 (27,3) | (24,5; 30,1) |
| Medicina | 222 (23,0) | (20,4; 25,7) |
| Otros | 250 (25,9) | (23,2; 28,7) |
| Departamento | ||
| Hospital y servicios centrales | 538 (55,8) | (52,7; 58,9) |
| UCI/Urgencias | 77 (8,0) | (6,3; 9,7) |
| Atención primaria | 349 (36,2) | (33,2; 39,2) |
DE: desviación estándar; mín.: mínimo; máx.: máximo; UCI: Unidad de Cuidados Intensivos; TUD: tiempo desde última dosis; IC: intervalo de confianza; TCAE: técnico en cuidados auxiliares de enfermería.
La vacuna BioNTech/Pfizer® se administró a 97,5% (940/964) del total de sujetos. El número de dosis administradas fue de dos en 98,5% (950/964) del total, y 86,4% (833/964) no fue diagnosticado de infección previa por COVID-19.
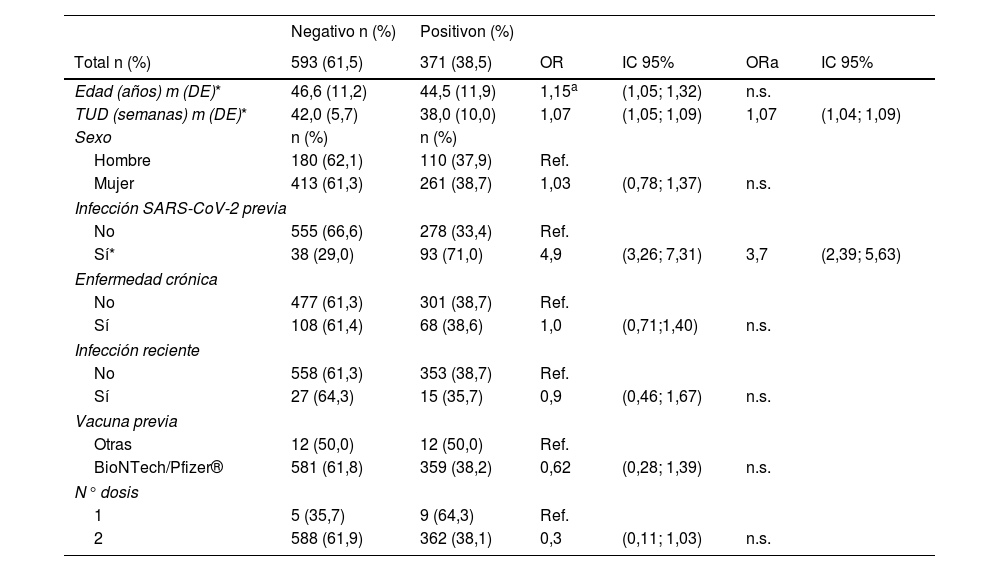
En total, fueron testados 964 sujetos para detección de anticuerpos neutralizantes contra el SARS-CoV-2 utilizando el kit de detección de anticuerpos neutralizantes contra el SARS-CoV-2 OJABIO®. De ellos, 593 (61,5%) fueron negativos y 371 (38,5%) positivos. En el análisis multivariable, el TUD de vacuna (ORa semana: 1,07; IC 95%: 1,04; 1,09) y la infección previa por SARS-CoV-2 (ORa: 3,7; IC 95%: 2,39; 5,63) fueron estadísticamente significativos con un resultado serológico positivo (tabla 2). Concretamente, la probabilidad de un resultado positivo para aquellos sujetos que habían padecido la infección por COVID-19 era aproximadamente cuatro veces mayor que entre aquellos que no la habían padecido.
Resultados de los test serológicos respecto a las variables demográficas y epidemiológicas-clínicas
| Negativo n (%) | Positivon (%) | |||||
|---|---|---|---|---|---|---|
| Total n (%) | 593 (61,5) | 371 (38,5) | OR | IC 95% | ORa | IC 95% |
| Edad (años) m (DE)* | 46,6 (11,2) | 44,5 (11,9) | 1,15a | (1,05; 1,32) | n.s. | |
| TUD (semanas) m (DE)* | 42,0 (5,7) | 38,0 (10,0) | 1,07 | (1,05; 1,09) | 1,07 | (1,04; 1,09) |
| Sexo | n (%) | n (%) | ||||
| Hombre | 180 (62,1) | 110 (37,9) | Ref. | |||
| Mujer | 413 (61,3) | 261 (38,7) | 1,03 | (0,78; 1,37) | n.s. | |
| Infección SARS-CoV-2 previa | ||||||
| No | 555 (66,6) | 278 (33,4) | Ref. | |||
| Sí* | 38 (29,0) | 93 (71,0) | 4,9 | (3,26; 7,31) | 3,7 | (2,39; 5,63) |
| Enfermedad crónica | ||||||
| No | 477 (61,3) | 301 (38,7) | Ref. | |||
| Sí | 108 (61,4) | 68 (38,6) | 1,0 | (0,71;1,40) | n.s. | |
| Infección reciente | ||||||
| No | 558 (61,3) | 353 (38,7) | Ref. | |||
| Sí | 27 (64,3) | 15 (35,7) | 0,9 | (0,46; 1,67) | n.s. | |
| Vacuna previa | ||||||
| Otras | 12 (50,0) | 12 (50,0) | Ref. | |||
| BioNTech/Pfizer® | 581 (61,8) | 359 (38,2) | 0,62 | (0,28; 1,39) | n.s. | |
| N° dosis | ||||||
| 1 | 5 (35,7) | 9 (64,3) | Ref. | |||
| 2 | 588 (61,9) | 362 (38,1) | 0,3 | (0,11; 1,03) | n.s. | |
Respecto a la edad, hubo diferencias significativas al considerarse como variable independiente, indicando que, a mayor edad, la tasa de positividad fue menor (OR 10 años: 1,15; IC 95%: 1,05; 1,32). No obstante, en el análisis multivariante no se observó significancia estadística de esta variable.
Observamos que la variable de TUD fue estadísticamente significativa con una correlación inversa a la probabilidad de un test serológico positivo.
Las variables sexo, presencia de enfermedad crónica, infección reciente, tipo de vacunas previas y número de dosis no mostraron diferencias estadísticamente significativas.
DiscusiónEn nuestro Departamento de Salud, 38,5% de los trabajadores sanitarios dieron positivo en anticuerpos neutralizantes del SARS-CoV-2 antes de la administración de la dosis de refuerzo. Estudios similares advirtieron sobre una disminución de la inmunidad contra la infección por SARS-CoV-2 en todos los grupos de edad unos meses después de recibir la segunda dosis de la vacuna BNT162b28,12,13. Concretamente, en un estudio prospectivo en personal sanitario, el nivel de anticuerpos neutralizantes disminuyó rápidamente durante los primeros tres meses, siendo relativamente más lento a partir de entonces, con una disminución más prominente en los hombres, las personas de 65 años o más y las personas inmunodeprimidas8. En nuestro caso, el resultado del test positivo no presentó diferencias significativas respecto al sexo. En cambio, la edad parece influir en la probabilidad de obtener positividad para anticuerpos neutralizantes anti-SARS-CoV-2.
Otro de los factores observados que influyen en el resultado positivo para el test serológico es el tiempo transcurrido desde la última dosis administrada. Aquellas personas que llevaban más tiempo sin recibir una dosis mostraron una menor tasa de resultado positivo para anticuerpos neutralizantes anti-SARS-CoV-2. En nuestro estudio, el tiempo transcurrido desde la última dosis de vacuna fue bastante largo (40,5 semanas ∼ 10 meses) y esto podría haber tenido un impacto importante en el deterioro serológico asociado a la presencia de anticuerpos neutralizantes anti-SARS-CoV-2. Además, podrían también asociar mayor riesgo a infecciones dado que las infecciones irruptoras aumentan significativamente con el tiempo transcurrido desde la administración de la segunda de vacuna BNT162b210 y también con una menor titulación de anticuerpos neutralizantes anti-SARS-CoV-225.
Por otro lado, nuestros resultados reflejan una asociación significativa entre infección previa por SARS-CoV-2 y resultado serológico positivo para anticuerpos neutralizantes anti-SARS-CoV-2. Estos datos son similares a los reportados en un estudio publicado recientemente realizado en la Universidad de Alicante en la que se observó una fuerte asociación entre ambas variables26. Además, esta asociación se ha observado en otros estudios de nuestro entorno donde los niveles para anticuerpos anti-SARS-CoV-2 frente a la proteína S o «Spike» en trabajadores sanitarios con infección previa por COVID-19 seis meses después de la vacunación, eran más altos que en aquellos vacunados sin antecedentes de COVID-1927, con una media en la titulación de anticuerpos anti-SARS-CoV-2 superior y un deterioro serológico más lento28,29, así como 84% menor riesgo de infección con un efecto protector medio observado siete meses después de la infección primaria30.
Para paliar esta disminución en la protección de la vacuna, una tercera dosis de refuerzo de la vacuna BNT162b2 contra el SARS-CoV-2 fue evaluada mediante ensayos clínicos9,25. Además, los resultados obtenidos por estudios «real-world» han resultado en que una tercera dosis de la vacuna de ARNm BNT162b2 es eficaz para proteger a las personas contra casos de COVID-19 severos concluyendo que, aunque la vacuna no es capaz de evitar la infección si es capaz de reducir la gravedad31–33. Por ello, las autoridades sanitarias competentes establecieron en sus estrategias de vacunación la administración de una tercera dosis de vacuna en grupos de riesgo, entre ellos, el personal sanitario23. Todos los participantes del estudio recibieron la tercera dosis de vacuna el día posterior al estudio en concordancia con las instrucciones de las autoridades sanitarias.
El test utilizado en nuestro estudio se trata de un ensayo de LFIC, el cual permite obtener resultados inmediatos. Este test serológico fue validado para la detección de anticuerpos neutralizantes anti-SARS-CoV-2 a mediados del año 202122. Nuestro estudio se realizó durante el mes de diciembre de 2021, por lo que la aparición de variantes emergentes en la brecha de tiempo entre la validación del test y el estudio podría ser una limitación. No obstante, la vacuna BNT162b2 ha mostrado ser eficaz para todas las variantes previas a la variante ómicron34, la cual no fue predominante en España hasta enero de 202235.
En el caso de la vacunación frente a COVID-19 se procede de forma análoga a la vacunación contra la gripe, actualizando la composición de la vacuna cuando se observa una reducción de más de cuatro veces en la actividad neutralizante ante nuevas cepas circulantes del virus con respecto a las previas36. De hecho, desde septiembre de 2023, la última versión de la vacuna Comirnaty BioNtech/Pfizer codifica la proteína de la espícula (S) viral del SARS-CoV-2 de la cepa Omicron XBB.1.5 en vez de la cepa Original Wuhan37.
ConclusiónNuestros datos sugieren que la duración de la protección por anticuerpos neutralizantes anti-SARS-CoV-2 está fuertemente influenciada por el tiempo transcurrido desde la administración de la última dosis de vacuna y por haber padecido la infección COVID-19 previo a la dosis de recuerdo.
FinanciaciónEste trabajo fue apoyado por un contrato de asesoramiento de la Universidad de Alicante con referencia WENZHOU-OJABIO1-21T, que permitió disponer de las pruebas serológicas rápidas facilitadas por la casa comercial OJABIO. Ningún autor ha recibido honorarios personales de la empresa biotecnológica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos a todos los trabajadores de salud que participaron en este estudio. En particular, queremos agradecer al director del Departamento de Salud de Orihuela, Dr. Miguel Elías Fayos, por su apoyo. También estamos agradecidos a los Supervisores de Enfermería del Departamento de Salud por su excelente labor.