4 - RECEPTOR SOLUBLE DE LA TRANSFERRINA COMO MARCADOR DE DÉFICIT TISULAR DE HIERRO: IMPACTO SOBRE EVENTOS CLÍNICOS EN PACIENTES CON INSUFICIENCIA CARDÍACA SIN DÉFICIT SISTÉMICO DE HIERRO NI ANEMIA
Hospital Universitari de Bellvitge, Hospitalet de Llobregat, España.
Objetivos: El receptor soluble de la transferrina (sTfR) es un marcador del estado de hierro a nivel tisular y puede traducir un déficit sutil en las reservas de hierro y un incremento de la demanda a nivel tisular incluso en ausencia de déficit sistémico. Niveles elevados de sTfR se han asociado con un incremento de la mortalidad en la población general y en pacientes con insuficiencia cardíaca (IC). Sin embargo, la significación pronóstica de la elevación del sTfR en pacientes con IC no ha sido evaluada. El objetivo del estudio es describir la asociación entre el sTfR, como marcador de déficit de hierro a nivel tisular, y los eventos clínicos en pacientes con IC sin anemia ni déficit sistémico de hierro.
Métodos: Estudio observacional, prospectivo, de cohortes de 1120 pacientes con IC (estudio DAMOCLES). Para el subestudio actual hemos seleccionado los pacientes con niveles normales de hemoglobina y sin déficit sistémico de hierro. La deficiencia tisular de hierro se ha definido como niveles de sTfR > 75 percentil (1,63 mg/l). Los objetivos primarios y secundarios fueron la mortalidad por todas las causas y la hospitalización por IC. Se ha desarrollado un modelo multivariado de riesgos proporcionales de Cox para explorar la asociación entre el déficit tisular de hierro y los eventos estudiados. Además, se han explorado las relaciones entre el sTfR y el riesgo β estimado de la ocurrencia de los eventos mediante un modelo aditivo generalizado (GAM). Todos los modelos han sido ajustados por edad, sexo y factores pronósticos de la IC.
Resultados: La cohorte final del estudio está formada por 215 pacientes. La edad media ha sido de 70 ± 12años y la FEVI media del 43 ± 15% con un 29% de mujeres. La media del valor de sTfR ha sido de 1,42 ± 0,66 mg/l. Se ha encontrado déficit tisular de hierro en 54 pacientes (25%). La readmisión hospitalaria por IC se ha evidenciado en 55 pacientes (25,6%) y la muerte en 60 (27,9%). En el modelo multivariado de riesgos proporcionales de Cox (tabla) niveles más altos de sTfR se han asociado de forma significativa con la mortalidad por todas las causas. Esta asociación no se ha apreciado en cuanto a la readmisión hospitalaria por IC. Tal y como se muestra en la figura, panel A, el modelo ajustado GAM muestra una asociación lineal significativa entre niveles más elevados de sTfR y el riesgo de muerte. Además, el riesgo acumulado ajustado de mortalidad por todas las causas (fig., panel B) confirma un riesgo más elevado de muerte en los pacientes con déficit tisular de hierro en comparación con aquellos con niveles de sTfR < 75 percentil, con una separación precoz de las curvas.
|
Mortalidad por todas las causas |
|||
|
Medidas del déficit tisular de hierro |
HR |
IC95% |
p |
|
sTfR, 1 mg/L |
1,455 |
1,121-1,887 |
0,005 |
|
sTfR > 75o percentil (1,63 mg/L) |
1,847 |
1,088-3,136 |
0,023 |
|
Hospitalización por insuficiencia cardíaca |
|||
|
Medidas del déficit tisular de hierro |
HR |
IC95% |
p |
|
sTfR, 1 mg/L |
1,174 |
0,829-1,663 |
0,366 |
|
sTfR > 75o percentil (1,63 mg/L) |
1,357 |
0,731-2,519 |
0,334 |
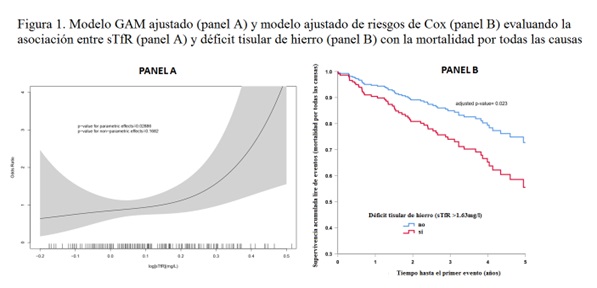
Conclusiones: En una cohorte de pacientes con IC sin déficit sistémico de hierro ni anemia, niveles más elevados de sTfR se asocian con un incremento de la mortalidad.






