443 - VALIDACIÓN DE UNA ESTRATEGIA DE PREVENCIÓN DE INFECCIÓN EN PORTADORES DE TRASPLANTE RENAL BASADA EN UN BUNDLE INDIVIDUALIZADO DE MEDIDAS Y UN SCORE DEL GRADO NETO DE INMUNOSUPRESIÓN
Hospital Universitario 12 de Octubre, Madrid.
Objetivos: Las infecciones continúan siendo una causa importante de morbimortalidad en el trasplante renal. La valoración de determinados antecedentes y ciertos parámetros inmunológicos permiten realizar recomendaciones individualizadas para disminuir el riesgo infeccioso. La hipótesis de este estudio es que el cumplimiento de un bundle o paquete de medidas individualizado con dichas determinaciones podría disminuir las infecciones en los primeros 12 meses postrasplante.
Métodos: Estudio prospectivo de aplicación de una estrategia individualizada de prevención de infecciones en una cohorte de trasplantados renales en el Hospital 12 de Octubre entre febrero 2018-septiembre 2019 (cohorte intervención); comparada con una cohorte de trasplantados renales en el mismo centro inmediatamente anterior al inicio de la parte prospectiva (febrero 2016-septiembre 2017; cohorte histórica). Se revisó al mes +1 postrasplante la vacunación frente a determinados patógenos (gripe, neumococo, VHB, VHA), riesgo infeccioso según lugar de origen (infecciones endémicas de Sudamérica y África) y de residencia (leishmaniosis), detección de infección tuberculosa latente (Mantoux/IGRA), ajuste de profilaxis según seroestatus donante/receptor (VEB,CMV), administración de inmunoglobulina humana específica (IgIV) (si IgG < 500 mg/dl) y ajuste de inmunosupresión según inducción y score de riesgo infeccioso (TCD4 < 50/uL, TCD8 < 100/uL, C3 < 83 mg/dl). Se recogió la indicación de cada medida y su cumplimiento en los primeros 12 meses-postrasplante. A parte, se registraron en ambas cohortes todos los eventos infecciosos del mes +2 al +12-postrasplante incluyendo necesidad de hospitalización.
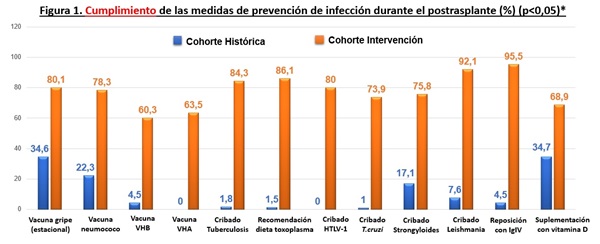
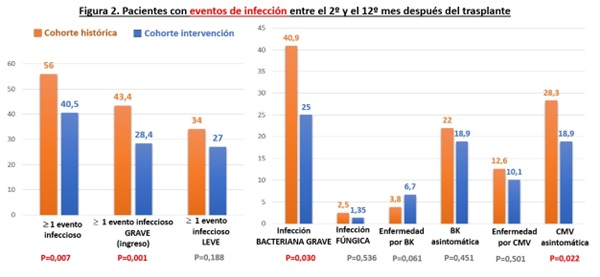
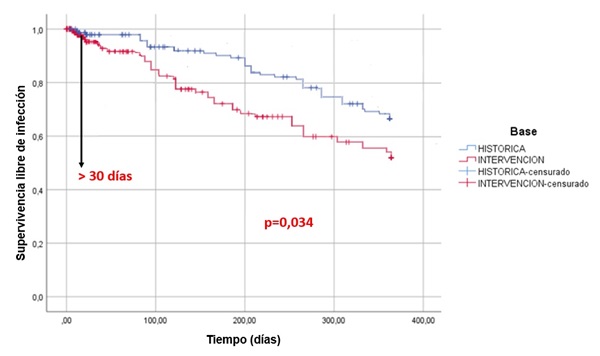
Resultados: Se compararon 159 pacientes de la cohorte histórica con 148 de la cohorte intervención. No se observaron diferencias estadísticamente significativas en sus características epidemiológicas, comorbilidad pretrasplante o causa de enfermedad renal crónica que motivó el trasplante (tabla). Se observó un cumplimiento significativamente mayor (p < 0,05) en la cohorte intervención de la vacunación de gripe (80 vs. 35%), antineumocócica (78 vs. 22%), VHB (60,3 vs. 4,5%) y VHA (63,5 vs. 0%). También hubo un mayor despistaje estadísticamente significativo de infección tuberculosa latente (84 vs. 2%), HTLV-1 (80 vs. 0%), estrongiloidiasis (79 vs. 17%) y leishmaniosis (92 vs. 7,6%) en pacientes de áreas endémicas (fig. 1). Los pacientes de la cohorte intervención tuvieron menos eventos infecciosos globales (40,5 vs. 56%; p = 0,007) y con necesidad de hospitalización (28,4 vs. 43%; p = 0,006), sobre todo bacterianos (27,7 vs. 42,8%; p = 0,006) y de positivización de CMV (viremia asintomática; 18,9 vs. 28,3%; p = 0,05) (fig. 2). Además, los trasplantados renales de la cohorte intervención presentaron significativamente y desde la aplicación del bundle, menos eventos infecciosos de cualquier durante el seguimiento (fig. 3). No hubo diferencias entre grupos en la incidencia de rechazo (12,6% cohorte histórica vs. 8,7% intervención, p = 0,262) ni mortalidad (2,5 vs. 1,4%, p = 0,686) durante el primer año postrasplante.
|
Cohorte de intervención (N = 148) |
Cohorte histórica (N = 159) |
p |
|
|
Edad del receptor, años [media ± DE] |
57,2 ± 14,7 |
56,2 ± 15,5 |
0,373 |
|
Género (hombre) |
112 (75,7%) |
105 (66,0%) |
0,079 |
|
Trasplante renal previo |
24 (16,2%) |
23 (14,6%) |
0,705 |
|
Comorbilidades pretrasplante |
|||
|
Diabetes mellitus |
39 (26,4%) |
38 (23,9%) |
0,62 |
|
Cardiopatía |
16 (10,8%) |
13 (8,2%) |
0,43 |
|
EPOC |
12 (8,1%) |
18 (11,3%) |
0,344 |
|
Neoplasia previa |
10 (6,8%) |
26 (16,4%) |
0,009 |
|
Causa de la ERC terminal: |
|||
|
Glomerulonefritis |
36 (24,3%) |
33 (20,8%) |
0,454 |
|
Nefropatía diabética |
30 (20,3%) |
24 (15,1%) |
0,709 |
|
Nefropatía hipertensiva |
14 (9,5%) |
18 (11,3%) |
0,594 |
|
Poliquistosis |
16 (10,8%) |
31 (19,5%) |
0,035 |
|
Nefropatía intersticial crónica |
12 (8,5%) |
10 (6,3%) |
0,537 |
|
Nefropatía lúpica |
2 (1,4%) |
3 (1,9%) |
0,711 |
|
Otra |
24 (16,2%) |
37 (23,3%) |
|
|
Serostatus CMV donante-receptor |
|||
|
CMV donante (+)/receptor (-) |
32 (33,7%) |
10 (6,3%) |
0,001 |
|
CMV donante (-)/receptor (-) |
18 (18,9%) |
14 (8,8%) |
0,018 |
|
Tipo de donante |
|||
|
Muerte encefálica |
80 (54,1%) |
103 (64,8%) |
0,056 |
|
Asistolia |
46 (31,1%) |
40 (25,2%) |
0,248 |
|
Donante vivo |
22 (14,9%) |
16 (13,6%) |
0,117 |
|
Número incompatibilidades HLA (mediana [Q1-Q3]) |
5 [4-5] |
4 [3-5] |
0,345 |
|
Esquema inmunosupresión inicial |
|||
|
Tacrolimus, MMF y esteroides |
142 (95,9%) |
155 (97,5%) |
0,124 |
|
Tacrolimus, azatioprina y esteroides |
6 (4,1%) |
4 (2,5%) |
0,239 |
|
Terapia de inducción |
|||
|
Ninguna |
15 (10,1%) |
17 (10,7%) |
0,873 |
|
Basiliximab |
58 (43,6%) |
59 (41,5%) |
0,598 |
|
Timoglobulina |
75 (56,4%) |
82 (57,7%) |
0,494 |
|
IgG < 500 mg/dl al mes +1 postrasplante |
22 (14,8%) |
20 (12,6%) |
0,478 |
Conclusiones: La aplicación de un bundle de medidas individualizadas de prevención de infección en el postrasplante renal supone una mejora significativa en el cumplimiento de diversas medidas preventivas y podría ser un factor adyuvante en la reducción de infecciones en los primeros 12 meses postrasplante.






