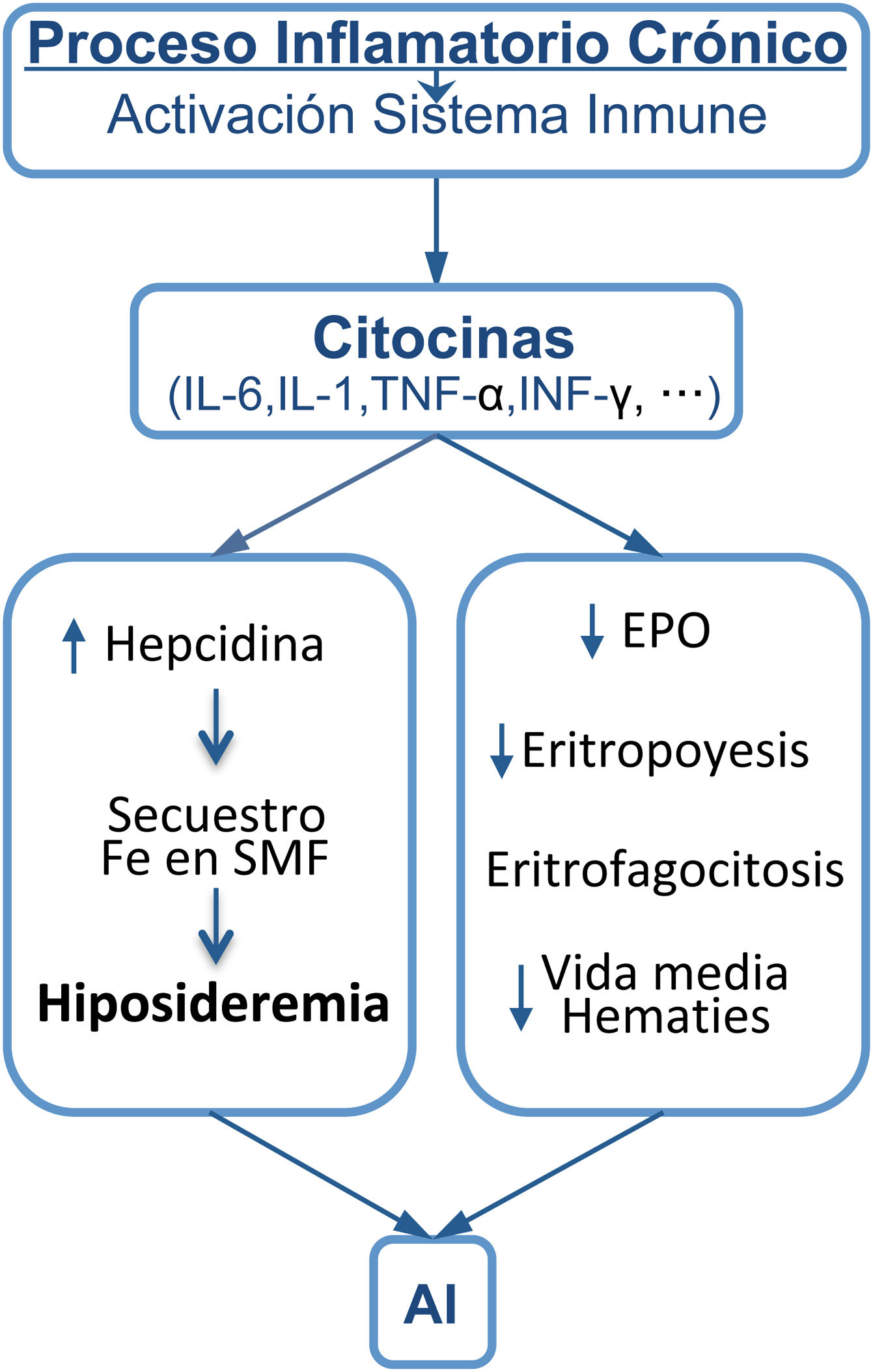
La anemia de la inflamación comienza con la activación del sistema inmune y la posterior liberación de citocinas que dan lugar a una elevación de la hepcidina, responsable de la hiposideremia y de la supresión de la eritropoyesis por falta de hierro. La anemia suele ser leve/moderada, normocítica/normocrómica, es la más prevalente después de la anemia ferropénica y es la más frecuente en los pacientes con enfermedades crónicas, en los ancianos y en los pacientes hospitalizados. La anemia puede influir en la calidad de vida del paciente y tener un impacto negativo en la supervivencia. El tratamiento debe dirigirse a mejorar la enfermedad de base y a corregir la anemia. El hierro intravenoso, la eritropoyetina y los inhibidores de la prolil hidroxilasa son la base actual del tratamiento, pero el futuro terapéutico va dirigido contra la hepcidina, que es la responsable final de la anemia.
Anemia of inflammation begins with the activation of the immune system and the subsequent release of cytokines that lead to an elevation of hepcidin, responsible for hypoferremia, and a suppression of erythropoiesis due to lack of iron. The anemia is usually mild/moderate, normocytic/normochromic and is the most prevalent, after iron deficiency anemia, and is the most common in patients with chronic diseases, in the elderly and in hospitalized patients. Anemia can influence the patient's quality of life and have a negative impact on survival. Treatment should be aimed at improving the underlying disease and correcting the anemia. Intravenous iron, erythropoietin and prolyl hydroxylase inhibitors are the current basis of treatment, but future therapy is directed against hepcidin, which is ultimately responsible for anemia.
Artículo
Diríjase desde aquí a la web de la >>>FESEMI<<< e inicie sesión mediante el formulario que se encuentra en la barra superior, pulsando sobre el candado.
Una vez autentificado, en la misma web de FESEMI, en el menú superior, elija la opción deseada.

>>>FESEMI<<<