Conocer la percepción y el manejo del cardiólogo clínico de la insuficiencia cardiaca con fracción de eyección reducida (IC-FER) y establecer un consenso con recomendaciones.
MétodosSe empleó el método Delphi modificado entre un panel de 150 expertos que respondieron un cuestionario que incluyó tres bloques: definición y percepción del paciente con IC-FER «estable» (15 afirmaciones), manejo del paciente con IC-FER «estable» (51 afirmaciones) y recomendaciones para optimizar el manejo y el seguimiento (9 afirmaciones). El nivel de acuerdo se evaluó utilizando una escala tipo Likert de 9 puntos.
ResultadosSe llegó a un consenso de acuerdo en 49 afirmaciones, a un consenso en el desacuerdo en 16 y quedaron indeterminadas 10 afirmaciones. Hubo consenso en cuanto a la definición de IC «estable» (82%), en que la IC-FER tiene una naturaleza silenciosa que puede contribuir a aumentar el riesgo de muerte en pacientes poco sintomáticos (96%), y que independientemente de que el paciente con IC-FER se mantenga estable en la misma clase funcional el tratamiento farmacológico debe optimizarse (98,7%). En cambio, hubo consenso en el desacuerdo con respecto a que el tratamiento con un inhibidor de neprilisina y receptor de angiotensina solo está justificado cuando hay un empeoramiento de la clase funcional (90,7%).
ConclusionesEl conocimiento actual sobre la IC «estable» es insuficiente; es necesaria la optimización del tratamiento, incluso en pacientes aparentemente estables, para disminuir el riesgo de progresión de la enfermedad.
To determine the perception and management of heart failure with reduced ejection fraction (HFrEF) by clinical cardiologists and to establish a consensus with recommendations.
MethodsWe employed the modified Delphi method among a panel of 150 experts who answered a questionnaire that included three blocks: definition and perception of patients with «stable» HFrEF (15 statements), management of patients with «stable» HFrEF (51 statements) and recommendations for optimising the management and follow-up (9 statements). The level of agreement was assessed with a Likert 9-point scale.
ResultsA consensus of agreement was reached on 49 statements, a consensus of disagreement was reached on 16, and 10 statements remained undetermined. There was consensus regarding the definition of «stable» HF (82%), that HFrEF had a silent nature that could increase the mortality risk for mildly symptomatic patients (96%) and that the drug treatment should be optimised, regardless of whether a patient with HFrEF remains stable in the same functional class (98.7%). In contrast, there was a consensus of disagreement regarding the notion that treatment with an angiotensin receptor-neprilysin inhibitor is justified only when the functional class worsens (90.7%).
ConclusionsOur current understanding of «stable» HF is insufficient, and the treatment needs to be optimised, even for apparently stable patients, to decrease the risk of disease progression.
La insuficiencia cardiaca (IC) es un síndrome clínico grave causado por una anomalía cardiaca estructural o funcional que puede estar presente tiempo antes de la aparición de los síntomas1-4. La IC «estable» se ha definido tradicionalmente como la ausencia de deterioro clínico, cambio de medicación y ausencia de hospitalizaciones5. Sin embargo, es bien conocido que la IC con fracción de eyección reducida (IC-FER) es un trastorno progresivo, aunque no siempre se detecte clínicamente6,7. De hecho, los pacientes con IC «estable» presentan una tasa de mortalidad por todas las causas en un año del 7,2% y una tasa de hospitalización al cabo de un año del 31,9%8,9.
El manejo de la IC es complejo debido en parte a la presencia de comorbilidades10. El algoritmo de tratamiento en pacientes con IC-FER incluye inhibidores de la enzima de conversión de la angiotensina (IECA) o antagonistas de los receptores de angiotensinaII (ARAII), betabloqueantes y antagonistas de la aldosterona. En los últimos años han aparecido dos nuevos tratamientos farmacológicos para la IC-FER: ivabradina y el inhibidor de la neprilisina y del receptor de la angiotensina (INRA)1,2. A pesar de que en los últimos años ha mejorado la supervivencia de los pacientes con IC-FER, los resultados siguen siendo insuficientes2,11. Dada la necesidad de concienciar sobre el riesgo que presentan estos pacientes, y con el objetivo de conocer mejor el manejo diagnóstico y terapéutico de esta patología por los cardiólogos clínicos, se realizó este estudio para intentar establecer unas recomendaciones de mejora en el manejo de los pacientes ambulatorios con IC.
MétodosDiseño del estudioEl estudio IC-BERG (Insuficiencia Cardiaca en consulta ambulatoria: paciente Estable, Retos y Guía de manejo), promovido por la Agencia de Investigación de la Sociedad Española de Cardiología, se ha realizado siguiendo el método Delphi modificado12 para obtener un consenso sobre el manejo de los pacientes con IC-FER atendidos en la consulta de cardiología. El método Delphi modificado se trata de una técnica estructurada de consenso profesional a distancia, variante del procedimiento original, que mantiene sus principales ventajas (interacción controlada entre los miembros del panel, oportunidad de reflexionar y reconsiderar la opinión propia sin perder el anonimato y validación estadística del consenso logrado) frente a otras técnicas y resuelve algunos de sus principales inconvenientes (sesgos de opinión).
El estudio se efectuó en cinco fases: a)constitución del comité científico; b)elaboración del cuestionario; c)selección del panel de expertos; d)administración del cuestionario, y e)recopilación, análisis e interpretación de resultados.
Constitución del comité científicoEl comité científico, formado por 6 miembros con una notable experiencia profesional en la cardiología clínica, creó el cuestionario, seleccionó el panel de expertos y analizó los resultados.
Elaboración del cuestionarioPara ello se llevó a cabo una búsqueda de bibliografía relevante en las bases de datos MEDLINE, EMBASE e Índice Médico Español13 para identificar los aspectos de la IC que pudieran resultar de interés para el estudio. A partir de esta información se creó el cuestionario final, que constaba de 75 afirmaciones (tabla suplementaria 1). Cada afirmación se respondía con una escala de tipo Likert de 9 valoraciones agrupadas en tres niveles: nada de acuerdo o nada apropiada (1-3), neutro (4-6) y totalmente de acuerdo o totalmente apropiada (7-9).
Las afirmaciones se organizaron en tres apartados: A.Definición y percepción del paciente con IC-FER «estable» (15 afirmaciones). B.Manejo del paciente con IC-FER «estable» (51 afirmaciones). C.Recomendaciones para optimizar el manejo y el seguimiento del paciente con IC-FER «estable» (9 afirmaciones).
Selección del panel de expertosEl comité científico del estudio IC-BERG seleccionó a los panelistas participantes de entre una base de datos. Esta selección se realizó estrictamente en base a la experiencia de los participantes en el área de cardiología clínica. En el proyecto han participado 150 cardiólogos de todo el territorio nacional (tabla suplementaria 2). Los criterios de selección fueron: que fueran cardiólogos clínicos, que no estuvieran adscritos a una unidad monográfica de IC en su práctica habitual, que tuvieran más de 2años de experiencia después de finalizar el periodo de formación, que trabajasen al menos 2días a la semana en consulta ambulatoria y que hubieran atendido a más de 20 pacientes con IC en los últimos 3meses (más de 7 al mes) (tabla suplementaria 2).
Administración del cuestionarioEl cuestionario fue remitido al panel de expertos mediante una plataforma online que garantizó la confidencialidad de los datos. La recogida de datos se desarrolló entre enero y marzo de 2019. Los 150 panelistas contestaron libremente a todas las preguntas en ambas rondas, sin recibir ninguna influencia externa para la contestación de las mismas.
Análisis e interpretación de resultadosSe realizó un análisis descriptivo de los resultados para cada afirmación del cuestionario. Se agruparon las respuestas para cada afirmación en tres niveles: 1-3, 4-6 y 7-9. Se definió «consenso en el acuerdo» cuando al menos el 70% de los expertos valoraba la afirmación con puntuaciones de 7-9, y «consenso en el desacuerdo» cuando al menos el 70% de los expertos valoraba la afirmación con puntuaciones de 1-314. El resto de posibilidades se definieron como consenso no alcanzado. Para realizar el análisis comparativo entre ambas rondas se utilizó el test de Bowker15, y el nivel de significación estadística establecido fue del 0,05 bilateral. Los datos fueron analizados mediante el paquete estadístico SPSS v22.
ResultadosEn la tabla suplementaria 2 se muestran las características de los panelistas. Del total de participantes, el 24% llevan más de 20años de ejercicio profesional atendiendo a pacientes con IC, con una media de 3,41días de consulta a la semana. El 58% atendían entre 16-50pacientes con IC al mes. Los panelistas indicaron que el 55,7% de los pacientes que atienden presentan IC-FER «estable».
En las tablas suplementarias 3-5 se muestran los resultados completos del cuestionario Delphi, mientras que en las tablas 1 y 2 aparecen aquellas en las que se logró consenso en el acuerdo o en el desacuerdo tras las 2 rondas, divididos en función de los distintos bloques analizados. En la primera ronda los panelistas llegaron a un consenso en un total de 59 afirmaciones (46 en el acuerdo y 13 en el desacuerdo). Las 16 afirmaciones restantes fueron sometidas a una segunda ronda de votaciones. En la segunda ronda se lograron consensuar 6 de las 16 afirmaciones re-consultadas (3 en el acuerdo y 3 en el desacuerdo). Así, al final del proceso Delphi se llegó a un consenso en 65 afirmaciones (49 en el acuerdo y 16 en el desacuerdo) y quedaron indeterminadas 10 afirmaciones. En las tablas se indica la significación del test de Bowker para comparar los resultados de ambas rondas (el valor de p fue <0,05, lo que indica que las respuestas de ambas rondas fueron significativamente distintas).
Definición y percepción del paciente con IC-FER «estable»: ítems en los que se llegó al consenso en la primera o segunda ronda del Delphi
| % de consenso en el acuerdo | p (test de Bowker) | |
|---|---|---|
| Definición de IC-FER | ||
| IC-FER: Diagnóstico clínico de IC y FEVI ≤ 40%. Siendo la IC un síndrome clínico complejo que resulta de cualquier deterioro estructural o funcional del llenado ventricular o de la eyección de sangre. Las manifestaciones cardinales de la IC son la disnea y la fatiga, que pueden limitar la tolerancia al ejercicio, y la retención de líquidos, que puede conducir a congestión pulmonar y/o esplácnica y/o edema periférico. (Guías ACC/AHA/HFSA) | 92,7% | NA |
| IC-FER: Diagnóstico clínico de IC y una FEVI ≤ 40%. Siendo la IC un síndrome clínico caracterizado por síntomas típicos (como disnea, inflamación de tobillos y fatiga), que puede ir acompañado de signos (como presión venosa yugular elevada, crepitantes pulmonares y edema periférico) causados por una anomalía cardiaca estructural o funcional que producen una reducción del gasto cardiaco o una elevación de las presiones intracardiacas en reposo o en estrés. (Guía ESC 2016) | 92% | 0,783 |
| Definición de paciente IC-FER «estable» | ||
| En un paciente con IC crónica, el término estabilidad suele hacer referencia a que los síntomas y signos son inexistentes o leves y que no han cambiado recientemente o al menos en el mes anterior, o desde la última visita médica de acuerdo con la práctica clínica | 82% | 0,001* |
| IC-FER «estable» y práctica clínica habitual actual | ||
| La naturaleza silenciosa pero progresiva de la IC-FER puede contribuir a aumentar el riesgo de muerte en pacientes que son asintomáticos o solo ligeramente sintomáticos | 96% | NA |
| Las calculadoras de riesgo desarrolladas recientemente tienen en cuenta los tratamientos de última generación y los niveles de biomarcadores y revelan que no existe una IC verdaderamente estable | 71,3% | 0,909 |
| La IC-FER es un trastorno progresivo por el cual la estructura y la función cardíacas continúan deteriorándose, a menudo a pesar de la ausencia de signos y síntomas clínicamente aparentes de un estado de empeoramiento de la enfermedad | 70,7% | NA |
| IC-FER «estable» y práctica clínica habitual actual | % de consenso en el desacuerdo | |
|---|---|---|
| Los pacientes con IC sintomática en algún momento (estadio C de la clasificación ACC/AHA) que no presenten síntomas y signos durante la visita clínica no tienen un riesgo considerable de muerte | 95,3% | NA |
| La naturaleza silenciosa pero progresiva de la IC-FER no contribuye a aumentar el riesgo de muerte en pacientes que son «clínicamente estables» | 94% | NA |
| El número de hospitalizaciones no se reduce si el paciente con IC-FER tiene un tratamiento optimizado | 92,7% | NA |
| El paciente con IC-FER «estable» es excepcional que tenga ingresos hospitalarios a corto/medio plazo | 70,7% | 0,186 |
ACC/AHA: American College of Cardiology/American Heart Association; FEVI: fracción de eyección del ventrículo izquierdo; IC-FER: insuficiencia cardiaca con fracción de eyección reducida; NA: no aplicable; NYHA: New York Heart Association.
Manejo del paciente con IC-FER «estable»: ítems en los que se llegó al consenso en la primera o segunda ronda del Delphi
| p (test de Bowker) | ||
|---|---|---|
| Evaluación y seguimiento del paciente con IC-FER «estable» en la práctica clínica habitual actual | % de consenso en el acuerdo | |
| En el seguimiento del paciente con IC-FER «estable» debe existir una colaboración total entre el cardiólogo y el médico de atención primaria | 99,3% | NA |
| El papel de enfermería es clave para fomentar la adherencia al tratamiento | 96,7% | NA |
| Disponer de una unidad de IC de referencia puede ser de utilidad en el manejo del paciente con IC-FER | 94,7% | NA |
| El paciente con IC-FER de difícil control debe ser seguido en una unidad de IC | 94,0% | NA |
| La clase funcional puede ser igual pero la IC-FER «estable» puede progresar | 94,0% | NA |
| Disponer de una unidad de cuidados paliativos puede ser de utilidad en el manejo del paciente con IC-FER | 92,7% | NA |
| En el manejo óptimo del paciente con IC-FER «estable» el médico de atención primaria es indispensable | 92,0% | NA |
| Para evaluar la progresión del paciente con IC-FER «estable» no basta solo con evaluar los signos y los síntomas clínicos | 91,3% | NA |
| El papel de enfermería es clave para detectar si los signos o síntomas de la IC-FER interfieren en la vida diaria del paciente | 90,7% | NA |
| En consulta, al paciente con IC-FER «estable» se debe consultar específicamente por cada signo y síntoma y su afectación a su calidad de vida | 88,0% | NA |
| El paciente con IC-FER «estable» debe examinarse al menos cada 6 meses para evaluar si su enfermedad ha empeorado, si deberían cambiar de medicación o si se debería considerar otro tipo de procedimientos | 84,7% | NA |
| El papel de enfermería es clave para detectar la necesidad de un cambio de tratamiento | 82,0% | NA |
| La necesidad de añadir o aumentar la dosis de un diurético de ASA indica que el paciente deja de ser estable | 80,0% | NA |
| Evaluación y seguimiento del paciente con IC-FER «estable» en la práctica clínica habitual actual | % de consenso en el desacuerdo | |
|---|---|---|
| En consulta no es necesario valorar si el paciente con IC-FER «estable» adapta su vida a medida que va reduciendo su capacidad física | 96,7% | NA |
| La resonancia magnética de corazón es una técnica imprescindible para evaluar si existe progresión de la IC-FER «estable» | 85,3% | 0,007* |
| El médico de atención primaria no puede hacer un seguimiento riguroso ni detectar la progresión de la IC-FER «estable» | 84,7% | NA |
| Para evaluar la progresión del paciente con IC-FER «estable» no es necesario medir los niveles de biomarcadores, tales como péptidos natriuréticos | 76,7% | NA |
| Cualquier paciente con insuficiencia cardíaca debe ser seguido en una unidad de insuficiencia cardíaca | 74,0% | NA |
| La clasificación funcional de la escala NYHA es una valoración objetiva | 73,3% | NA |
| Tratamiento del paciente con IC-FER «estable» en la práctica clínica habitual actual | % de consenso en el acuerdo | |
|---|---|---|
| En cada visita, es primordial valorar la adherencia al tratamiento del paciente con IC-FER «estable» | 98,7% | NA |
| Independientemente de que el paciente con IC-FER se mantenga en la misma clase funcional, el tratamiento farmacológico debe optimizarse | 98,7% | NA |
| La terapia médica del paciente con IC-FER «estable» puede optimizarse con los nuevos avances científicos | 95,3% | NA |
| La incorporación de nuevos fármacos en pacientes menos sintomáticos puede enlentecer la progresión subclínica de la enfermedad | 95,3% | NA |
| Si el paciente con IC-FER presenta signos o síntomas leves persistentes que afectan su calidad de vida, es necesario valorar un cambio de tratamiento | 95,3% | NA |
| Independientemente de que el paciente con IC-FER esté «estable», el tratamiento farmacológico debe titularse a dosis objetivo | 94,7% | NA |
| En caso que el paciente con IC-FER se mantuviera sintomático a pesar de las dosis máximas toleradas sería necesario cambiar de tratamiento | 84,0% | NA |
| La necesidad de añadir o aumentar un diurético indica que el paciente deja de estar estable | 79,3% | NA |
| El cambio de un IECA o un ARAII a un INRA no debe reservarse hasta que aparezca una descompensación clínica | 71,3% | NA |
| Tratamiento del paciente con IC-FER «estable» en la práctica clínica habitual actual | % de consenso en el desacuerdo | |
|---|---|---|
| El tratamiento del paciente con IC-FER «estable» con INRA solo está justificado cuando hay un empeoramiento de la clase funcional | 90,7% | NA |
| Si el paciente con IC-FER presenta signos o síntomas leves persistentes no es necesario valorar un cambio de tratamiento | 88,0% | NA |
| Optimizar el tratamiento es exclusivamente titular a dosis máxima tolerada | 74,7% | NA |
| Si el paciente con IC-FER no presenta signos o síntomas no es necesario valorar un cambio de tratamiento | 74,7% | NA |
| Las diferentes comorbilidades que puede padecer el paciente con IC-FER «estable» no limitan el tratamiento idóneo | 72,7% | NA |
| En el tratamiento del paciente con IC-FER «estable» debe primar la experiencia a las recomendaciones de las guías | 70,0% | 0,029* |
| Abordaje en consulta del paciente con IC-FER «estable» en la práctica clínica habitual actual | % de consenso en el acuerdo | |
|---|---|---|
| Preguntar específicamente sobre si el paciente con IC-FER «estable» siente más o menos fatiga que en la visita anterior | 96,7% | NA |
| Sondear específicamente sobre si el paciente con IC-FER «estable» ha reducido su actividad o ha dejado de hacer alguna actividad | 95,3% | NA |
| Preguntar específicamente sobre si el paciente con IC-FER «estable» se ahoga más o menos por la noche que en la visita anterior | 95,3% | NA |
| Consultar específicamente sobre si el paciente con IC-FER «estable» se cansa más o menos que en la visita anterior | 94,0% | NA |
| Consultar específicamente sobre si el paciente con IC-FER «estable» ha retenido líquidos | 92,7% | NA |
| Recomendaciones de abordaje en el paciente con IC-FER «estable» en la práctica clínica habitual | % de consenso en el acuerdo | |
|---|---|---|
| Fomentar y comprobar la adherencia al tratamiento | 100,0% | NA |
| Revisar la necesidad de modificar el tratamiento | 98,7% | NA |
| Recomendar control de peso, si procediera | 96,0% | NA |
| Promover hábitos saludables con medidas de autocuidado (presión arterial y frecuencia cardíaca) | 96,0% | NA |
| Estimular la actividad física adecuada al paciente con IC | 94,7% | NA |
| Recomendar vacunación antigripal anual | 90,7% | NA |
| Recomendar vacunación antineumocócica | 86,0% | NA |
| Recomendaciones basadas en la experiencia clínica en pacientes con IC-FER «estable» | % de consenso en el acuerdo | |
|---|---|---|
| Es necesario concienciar sobre la necesidad de la optimización del tratamiento del paciente con IC-FER «estable» | 100% | NA |
| El profesional sanitario debe estar al día de los últimos avances terapéuticos | 100% | NA |
| Es necesario concienciar sobre la progresión de la IC-FER «estable» | 99,3% | NA |
| Se debe promover la continuidad asistencial y la coordinación entre cardiología y atención primaria | 99,3% | NA |
| El profesional sanitario debe contar con herramientas útiles de evaluación de progresión de la IC-FER | 99,3% | NA |
| Se debe formar al profesional sanitario en relación a la identificación de la progresión de la IC-FER | 99,3% | NA |
| Se debe formar al paciente en la importancia de la adherencia al tratamiento para la IC-FER | 99,3% | NA |
| Es necesario sensibilizar al profesional sanitario sobre el seguimiento de las guías de manejo del paciente con IC-FER «estable» | 98,0% | NA |
| La entrevista clínica entre el profesional sanitario y el paciente con IC-FER debería estar protocolizada | 77,3% | NA |
ACC/AHA/HFSA: American College of Cardiology/American Heart Association/ Heart Failure Society of America; ARAII: antagonistas del receptor de la angiotensinaII; ESC: European Society of Cardiology; IC: insuficiencia cardiaca; IC-FER: insuficiencia cardiaca con fracción de eyección reducida; IECA: inhibidor de la enzima de conversión de la angiotensina; INRA: inhibidor de la neprisilina y del receptor de la angiotensina; NA: no aplicable.
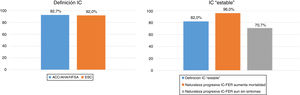
En cuanto a la definición y percepción del paciente con IC-FER «estable» (tabla 1, fig. 1), hubo un elevado consenso, en cuanto a la definición de IC «estable» (82% de panelistas), en que la IC-FER tiene una naturaleza silenciosa que puede contribuir a aumentar el riesgo de muerte en pacientes que están asintomáticos o poco sintomáticos (96%). Asimismo, también hubo un alto grado de consenso en el desacuerdo acerca de que los pacientes con IC sintomática, si no presentan síntomas y signos marcados de IC, no tienen un riesgo considerable de muerte (95,3%).
Porcentaje de consenso en el acuerdo sobre la definición de IC y sobre la naturaleza de IC «estable».
ACC/AHA/ HFSA: American College of Cardiology/American Heart Association/Heart Failure Society of America; ESC: European Society of Cardiology; IC: insuficiencia cardiaca; IC-FER: insuficiencia cardiaca con fracción de eyección reducida.
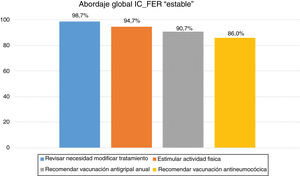
Con respecto al manejo del paciente con IC-FER «estable» (tabla 2, figs. 2 y 3), hubo un amplio consenso en que en el seguimiento de estos pacientes supuestamente «estables» debe existir una colaboración total entre el cardiólogo y el médico de atención primaria (99,3%), que el papel de enfermería es clave (96,7%) y que disponer de una unidad de IC de referencia puede ser de utilidad (94,7%). Asimismo, hubo un elevado grado de consenso en que, aunque el paciente con IC-FER se mantenga en la misma clase funcional, el tratamiento farmacológico debe optimizarse (98,7%), y que la necesidad de añadir o aumentar un diurético indica que el paciente deja de estar estable (79,3%). Hubo un elevado grado de consenso en el desacuerdo con respecto a que en la consulta no es necesario valorar si el paciente con IC-FER «estable» adapta su vida a medida que va reduciendo su capacidad física (96,7%), ni que el tratamiento del paciente con IC-FER «estable» con el INRA solo está justificado cuando hay un empeoramiento de la clase funcional (90,7%).
Porcentaje de consenso en el acuerdo sobre la evaluación, seguimiento y tratamiento de la IC-FER «estable».
ARAII: antagonistas del receptor de la angiotensinaII; CF: clase funcional; IC-FER: insuficiencia cardiaca con fracción de eyección reducida; IECA: inhibidor de la enzima de conversión de la angiotensina; INRA: inhibidor de la neprisilina y del receptor de la angiotensina.
La mortalidad de la IC-FER sigue siendo elevada, por lo que establecer mejoras en su manejo es fundamental. En este estudio se muestra el consenso sobre que la IC-FER «estable» no es un proceso banal, sino que se asocia a un elevado riesgo de progresión de la enfermedad, y que, por lo tanto, es necesario concienciar al profesional sanitario sobre este hecho y, en consecuencia, la necesidad de optimizar el tratamiento y el seguimiento en estos pacientes.
Uno de los aspectos más relevantes que se desprenden de los resultados del presente trabajo es la falta de acuerdo sobre la definición de IC-FER «estable», ya que solamente se alcanzó el consenso en el acuerdo en una de las tres definiciones, lo que indica que el conocimiento real sobre esta entidad es realmente incierto. Esto puede deberse, entre otros motivos, a que probablemente no existe una IC «estable» como tal, ya que en realidad sigue progresando16-18. En este sentido, los expertos llegaron al consenso en que puede existir progresión de la enfermedad sin cambios en la clase funcional, al no estar necesariamente relacionada de forma directa la progresión con la clase funcional. Además, la clasificación de la NYHA fue considerada por los panelistas como una evaluación subjetiva de los síntomas y de la capacidad de esfuerzo del paciente, lo que se corresponde con el hecho de que se ha demostrado una falta de concordancia entre la clase funcional NYHA indicada por el médico y la considerada por el paciente19. Por tanto, para valorar al paciente con IC la simple evaluación de la clase funcional puede ser insuficiente. En definitiva, de estos resultados se desprende la idea de que para los expertos el concepto de estabilidad en la IC no es correcto. Más bien es un trastorno crónico, con desestabilizaciones periódicas que obligan a la optimización del tratamiento.
Otro aspecto relevante es que, a pesar de que numerosos estudios han demostrado el elevado riesgo de muerte súbita en pacientes con IC-FER y una clase funcional no muy avanzada17,18, el panel de expertos no llegó a un consenso en este sentido, lo que podría conducir a una falta de optimización del tratamiento.
Una duda que surge habitualmente entre los médicos que atienden a los pacientes con IC es si realmente se debería considerar como «estable» a un paciente que necesita diuréticos para mantener el estado euvolémico. De hecho, el panel de expertos no llegó a alcanzar un consenso sobre este punto, únicamente que, si se aumenta la dosis de diurético de asa, ello indica que el paciente deja de estar «estable». Sin embargo, los estudios señalan que pacientes sin datos de congestión que reciben una dosis mayor de diuréticos presentan una mayor mortalidad20,21. Por lo tanto, un paciente que necesita diuréticos no debería ser considerado como un paciente «estable».
Para optimizar el seguimiento del paciente es preciso realizar una correcta y puntual evaluación del mismo. Las guías NICE recomiendan que se examine a los pacientes con IC «estable» al menos cada 6meses5. En nuestro estudio, los expertos llegaron a un elevado consenso en el acuerdo con esta recomendación. Además, consensuaron que hacer una valoración clínica básica no es suficiente y que es necesario en cada visita indagar si el paciente tiene «nuevos» síntomas y si adapta la vida a estos.
En las actuales guías de práctica clínica se recomienda determinar los péptidos natriuréticos para evaluar la gravedad de la enfermedad, establecer el pronóstico y prevenir la progresión de la IC1,2. Además, la reducción de los péptidos natriuréticos con el tratamiento se ha asociado a una menor mortalidad y hospitalización por IC22,23. En este sentido, los expertos llegaron a un consenso sobre la necesidad de medir niveles de biomarcadores durante el seguimiento, lo que podría ayudar a optimizar el tratamiento.
Aunque una baja distancia recorrida en la prueba de 6minutos de marcha es un marcador pronóstico desfavorable de la IC2, y existe una correlación inversa entre la clase funcional y la distancia recorrida24, los expertos no llegaron a un consenso sobre la necesidad de la prueba de 6minutos para la valoración clínica del paciente en las consultas del cardiólogo clínico. Los expertos tampoco consideraron que la resonancia magnética cardiaca fuese una técnica imprescindible para la evaluación de la IC-FER estable. Y es que, a pesar de que la resonancia cardiaca aporta información relevante, no se consideró imprescindible, sobre todo para el seguimiento2,25. Asimismo, y aunque el tratamiento adecuado de la IC puede hacer mejorar la fracción de eyección26, y que la falta de mejoría se asocia a un peor pronóstico27, los expertos no llegaron a un consenso sobre la necesidad de medir la fracción de eyección durante el seguimiento. En consecuencia, la necesidad de la optimización del tratamiento de la IC probablemente no va a depender tanto de la realización de pruebas de imagen como de la valoración clínica.
Los expertos consensuaron en el acuerdo todas las afirmaciones relacionadas con el seguimiento desde los diferentes servicios asistenciales, confirmando que el seguimiento del paciente con IC-FER debe realizarse coordinadamente entre los diferentes niveles asistenciales, promoviendo la educación médica continuada necesaria para mejorar el manejo de estos pacientes2,3. No hay que olvidar que una adecuada coordinación entre los niveles asistenciales se ha demostrado que mejora el pronóstico de los pacientes con IC y reduce las hospitalizaciones28. Por otra parte, el manejo clínico depende no solo de los recursos y de la organización asistencial, sino que debe adaptarse a las características de cada paciente29. En este sentido, desde la sección de cardiología clínica se está desarrollando el programa MICCAP, que tiene como objetivo principal mejorar la coordinación entre atención primaria y cardiología para mejorar la atención al paciente con IC30.
El tratamiento optimizado tiene como objetivo enlentecer la progresión de la enfermedad, mejorar la calidad de vida y el pronóstico de los pacientes2,31. Así, los expertos consensuaron que es necesario valorar un cambio de tratamiento con independencia de la supuesta estabilidad clínica e independientemente de que el paciente se mantenga en la misma clase funcional. Por ejemplo, el panel de expertos consensuó que el cambio de un IECA o un ARAII a un INRA no debe demorarse hasta que aparezca una descompensación clínica o un empeoramiento de la clase funcional, pues esto se asociaría a un peor pronóstico y a una pérdida de oportunidad para optimizar el tratamiento en la consulta. De hecho, el INRA ha demostrado ser superior a IECA (enalapril) en la reducción del riesgo de muerte y hospitalización en pacientes con IC-FER que mayoritariamente estaban en clase funcional NYHAII/IV32,33, siendo una de las recomendaciones realizadas por las guías de práctica clínica2,31.
Este estudio, como otros trabajos con un diseño similar, tiene algunas posibles limitaciones que deben ser mencionadas. La selección de los expertos se realizó únicamente en el ámbito territorial español y todos los panelistas se enmarcan dentro de la especialidad de cardiología clínica. Si bien esto podría implicar un cierto sesgo territorial o de especialidad, los panelistas fueron elegidos por ser expertos en la materia. Así, en este consenso no se ha considerado la opinión de otros profesionales que también podrían estar en contacto con esta patología. Finalmente, entre las fortalezas del estudio cabe destacar el elevado número de participantes (150 expertos) y la reconocida utilidad del método Delphi para obtener conclusiones, ya que garantiza el anonimato y también que el participante tenga el tiempo suficiente para la reflexión individual, minimizando el sesgo de influencia interpersonal y la presión del tiempo12.
ConclusionesEl concepto de IC «estable» no es bien reconocido entre todos los expertos y favorece la inercia terapéutica. La IC es una enfermedad progresiva, incluyendo el grupo de pacientes considerados teóricamente como «estables», por lo que se debería valorar la optimización del tratamiento en cada consulta y no esperar a que haya un empeoramiento de la sintomatología. Los resultados de este estudio Delphi permitirán elaborar propuestas de mejora en la atención a los pacientes ambulatorios con IC-FER.
FinanciaciónEl promotor del estudio fue la Agencia de Investigación de la Sociedad Española de Cardiología, que contó con una beca no condicionada de Novartis.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a los panelistas su participación como expertos en el consenso Delphi, ya que sin ellos no hubiese sido posible la realización de este trabajo.