La infección por SARS-CoV-2 se relaciona con un riesgo alto de malnutrición, principalmente por el aumento de los requerimientos nutricionales y la presencia de un estado inflamatorio severo y universal. Los síntomas asociados contribuyen a la hiporexia, que perpetúa el balance nutricional negativo. Además, la disfagia, especialmente posintubación, empeora y hace poco segura la ingesta. Este riesgo es mayor en pacientes ancianos y multimórbidos. La inflamación en distinto grado es el nexo común entre la COVID-19 y la aparición de desnutrición, siendo más correcto hablar de desnutrición relacionada con la enfermedad (DRE). La DRE empeora el mal pronóstico de la infección por SARS-CoV-2, sobre todo en los casos más severos. Por ello es necesario identificar y tratar precozmente a las personas en riesgo, evitando la sobreexposición y el contacto directo con el paciente. No podemos olvidarnos del papel que juega la dieta saludable tanto en la prevención como en la recuperación tras el alta.
SARS-CoV-2 infection is associated with a high risk of malnutrition, mainly due to increased nutritional requirements and the presence of a severe and universal inflammatory state. Associated symptoms contribute to hyporexia, which perpetuates the negative nutritional balance. Furthermore, dysphagia, especially post-intubation, worsens and makes intake unsafe. This risk is greater in elderly and multimorbid patients. Inflammation to varying degrees is the common link between COVID-19 and the onset of malnutrition, and it is more correct to refer to disease-related malnutrition (DRM). DRM worsens the poor prognosis of SARS-CoV-2 infection, especially in the most severe cases. Therefore, it is necessary to identify and treat people at risk early, avoiding overexposure and direct contact with the patient. We cannot forget the role that a healthy diet plays in both prevention and recovery after discharge.
La Organización Mundial de la Salud ha declarado como emergencia pública mundial la epidemia por el Coronavirus del Síndrome Respiratorio Agudo Grave (SARS-CoV-2) y la enfermedad que produce, COVID-191. Desde diciembre del 2019, cuando se identificaron los primeros casos hasta la fecha, hemos pasado de considerarla como un proceso infeccioso principalmente respiratorio a pensar en ella como una enfermedad sistémica que puede comprometer severamente la vida del paciente2.
El 80% de los casos presenta síntomas leves; un 15% desarrolla una enfermedad severa y el 5% restante, una enfermedad crítica con síndrome de distrés respiratorio agudo (SDRA) y fallo multiorgánico. Hasta el 20% de los pacientes precisa un ingreso prolongado en la UCI con las secuelas funcionales que ocasiona3.
La infección por SARS-CoV-2 se relaciona con un riesgo alto de desarrollo de malnutrición, principalmente por el aumento de los requerimientos nutricionales y la presencia de un estado inflamatorio severo y universal. Además, otros síntomas, como la tos, la disnea, la diarrea y la pérdida del gusto o del olfato, contribuyen a un estado hiporéxico que perpetúa el balance nutricional negativo. Así mismo, la disfagia orofaríngea, especialmente postintubación, empeora y hace poco segura la ingesta4.
Aunque la COVID-19 puede afectar a todos los tramos etarios y producir enfermedad severa en ellos, debemos prestar especial atención a los pacientes ancianos, con multimorbilidad o que previamente estaban desnutridos, en los que el riesgo de ingreso en UCI es mayor5.
La mortalidad por COVID-19 en pacientes ancianos es dramática6. Esta vulnerabilidad está ligada al desgaste biológico inherente a la edad, a la mayor prevalencia de comorbilidades y a que hasta el 50% de los pacientes ancianos que necesitan hospitalización presentan desnutrición en diverso grado7,8.
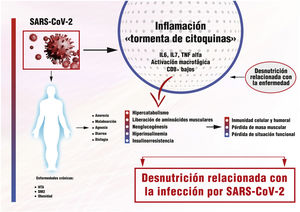
Hemos aprendido de otras pandemias por virus, como el MERS-CoV o la Gripe 1 (H1N1)9,10, que los factores de riesgo para las enfermedades infecciosas dependen tanto del huésped, del patógeno como del medio ambiente. Se han descrito diversos factores asociados a la severidad y un peor pronóstico en la COVID-19 como: la edad, la presencia de enfermedades crónicas como diabetes mellitus tipo 2 (DM2), la hipertensión arterial (HTA) o la obesidad y las enfermedades del sistema inmune11,12. Si existe algo que las conecta a todas es la inflamación, en menor o mayor grado13, y es esta respuesta inflamatoria exagerada, denominada «tormenta de citoquinas», el desencadenante principal de una presentación clínica severa y la muerte por COVID-1914,15.
Esta «tormenta de citoquinas» se caracteriza, por un lado, por niveles elevados de citoquinas proinflamatorias, especialmente las interleukinas (IL) 6 y 7 y el factor de necrosis tumoral (TNF) alfa, y, por otro, por un síndrome de activación macrofágica, infiltración monocitaria en pulmón, hígado, riñón o ganglios linfáticos y una profunda linfopenia16-18. Los niveles elevados de citoquinas se correlacionan negativamente con los de linfocitos T, especialmente CD8 + y estos con la severidad de la infección. Se ha postulado que esta severa depleción de la inmunidad celular podría estar relacionada con el desplazamiento linfocitario hacia los tejidos inflamados, pero no con una infección directa de las células T por el virus19.
Como se ha mencionado, los factores de riesgo para las enfermedades infecciosas dependen también del medio ambiente. La sociedad ha ido alejándose del patrón de estilo de vida mediterráneo hacia modos de vida más occidentales, en los que predominan dietas ricas en grasas saturadas, hidratos de carbono y azúcares refinados, pobres en fibra, antioxidantes y grasas poliinsaturadas. Estas dietas son proinflamatorias; inducen lipotoxicidad y aumentan el estrés oxidativo, activando el sistema inmune innato a través de macrófagos y neutrófilos e inhibiendo el sistema inmune adaptativo, alterando la producción y maduración de C20,21.
En último lugar, sin olvidarnos de los otros dos actores, el patógeno y el medio ambiente, está el huésped. Cuando hablamos de desnutrición solemos referirnos a la relacionada con la hambruna o con la ingesta inadecuada, de elevada morbimortalidad. La desnutrición condiciona la enfermedad y esta empeora la primera, siendo correcto entonces referirnos al binomio desnutrición-enfermedad.
Sin embargo, en el contexto que nos ocupa, debemos incluir un concepto más en la ecuación: nuevamente la inflamación. Por eso, es más apropiado hablar de desnutrición relacionada con la enfermedad (DRE). La DRE se define como una alteración de la composición corporal producida por un déficit de nutrientes (por disminución de la ingesta, aumento de las pérdidas o de los requerimientos), como consecuencia de una enfermedad aguda o crónica, que disminuye las funciones vitales y repercute de forma negativa en la evolución clínica. La DRE aumenta la morbimortalidad, empeora el pronóstico, los costes y la calidad de vida del paciente.
En 2010, las sociedades europeas y americanas de nutrición, ESPEN y ASPEN, elaboraron un documento de consenso para definir la DRE y el ayuno, poniendo en valor el papel de la respuesta inflamatoria sistémica, que está presente en distinto grado tanto en la enfermedad aguda como en la crónica, en el desarrollo de la DRE22.
En 2019, The Global Leadership Initiative on Malnutrition (GLIM) elaboró un documento de consenso para el diagnóstico de la DRE. Se basaba en criterios fenotípicos (pérdida ponderal involuntaria, bajo índice de masa corporal o pérdida de masa muscular), a los que se añadía, como novedad, un criterio etiológico, entre el que se encuentra nuevamente la inflamación asociada a la enfermedad23.
Parece obvio el papel de la inflamación tanto en la fisiopatología de la DRE, como en una forma de presentación clínica severa en la COVID-19. La agresión, en nuestro caso, la infección por SARS-CoV-2, da lugar a una respuesta inflamatoria, inicialmente beneficiosa si está bien controlada, que desemboca en casos severos en la mencionada «tormenta de citoquinas» con graves consecuencias metabólicas. Con ella se aumenta el gasto energético, se liberan aminoácidos musculares utilizados tanto para la neoglucogénesis como para la síntesis proteica, tan necesarias para el sistema inmune y la reparación tisular.
Paralelamente, los cambios hormonales contribuyen a modificar la respuesta metabólica. La hiperinsulinemia eleva la producción de cuerpos cetónicos y su utilización como sustrato a nivel cerebral. A la larga, esta situación de hiperinsulinemia e insulinorresistencia empeora la hiperglucemia, un conocido factor de aumento de morbimortalidad24, a lo que se une la hipertrigliceridemia secundaria, la lipólisis y la oxidación de ácidos grasos25. El corazón puede llegar a perder el 30% de su peso habitual, por disminución de miofibroblastos, necrosis o infiltrados inflamatorios.
A nivel pulmonar, disminuye el número de macrófagos alveolares y descienden los niveles de surfactante pulmonar, haciendo al individuo más susceptible a la agresión. Se producen modificaciones en la síntesis y secreción de la hormona del crecimiento, de la insulina, el glucagón o las gonadotrofinas26. Parecen claras las consecuencias deletéreas que la aparición de la DRE tiene en el curso clínico de la COVID-19. Por su implicación, por un lado, en la aparición de una respuesta inmune defectuosa e insuficiente. Y, por otro, en la aparición de sarcopenia, secundaria al desacondicionamiento físico que producen la pérdida de masa muscular y de capacidad funcional, perpetuando el círculo y enlenteciendo la recuperación del paciente27(fig. 1).
La identificación del riesgo de desnutrición y la instauración de un soporte nutricional adecuado y precoz, desde el primer contacto con el paciente, son pilares fundamentales para mejorar el pronóstico de la COVID-1928,29. Pero ¿cómo hacerlo? Hemos de adaptar el algoritmo universal de manejo nutricional a estas condiciones clínicas y epidemiológicas.
La necesidad de una rigurosa protección personal por la alta contagiosidad limita el contacto con el paciente y el uso de instrumentación, tanto para la evaluación del estado nutricional, de la disfagia o la sarcopenia, como para el tratamiento. Es recomendable limitar el tiempo y la frecuencia del contacto, evitar el uso de material reutilizable y los procedimientos que puedan generar aerosoles. Sin embargo, hay un arma a nuestro alcance fácil de usar y asequible, la historia clínica, en la que deberíamos basar nuestro plan terapéutico y que nos permite, con escasos recursos, acercarnos a las necesidades del paciente.
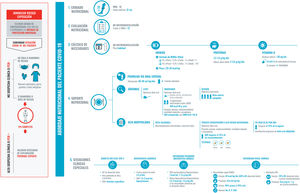
El soporte nutricional adecuado debe formar parte activa del plan integral de tratamiento durante todo el proceso de la infección. Este plan nutricional debe ser reevaluado y reorientado al cálculo de las necesidades (fig. 2), a la presencia de disfagia (fig. 3) y sarcopenia (fig. 4). Un correcto estado nutricional reduce las complicaciones, la estancia en UCI, la hospitalización, así como las secuelas29.
Recomendaciones para el abordaje nutricional del paciente COVID-19 hospitalizado.
La exposición ha de ser segura minimizando el riesgo de contagio. Por ello, debemos ser prácticos, realizar una correcta historia clínica y utilizar material desechable. Los cinco puntos fundamentales serán:
1. Cribado nutricional, para el que se utilizará el test MNA-SF (por sencillez y porque no se necesita contacto con el paciente; otro test validado, pero en este caso no indicado porque se necesita contacto estrecho con el paciente para el cálculo del IMC, el NRS-2002) y un diámetro de pantorilla inferior a 31 cm. El cribado nutricional se realizará a ser posible en las primeras 48 horas tras el ingreso.
2. Evaluación nutricional: historia clínica y considerar desnutrición un MNA con puntuación inferior a 12 puntos.
3. Cálculo de necesidades, según el peso habitual del paciente y el peso ideal en caso de obesidad.
4. Soporte nutricional: se priorizará la dieta oral, optimizándola siempre que sea posible. Si la ingesta no es adecuada se suplementará con dos SNO de alta densidad calórica y proteica, con proteínas de alta densidad biológica especialmente si hay sarcopenia o es un anciano con multimorbilidad.
Si alcanzar las necesidades diarias está severamente comprometido se procederá a una dieta enteral completa, evitando las sondas siempre que sea posible. Tras el alta hospitalaria se tendrá muy presente la continuidad asistencial, se reforzará la dieta oral manteniendo la suplementación hasta que el paciente alcance el 70% de sus necesidades.
5. Tener en cuenta las condiciones clínicas más habituales de los pacientes ingresados que pueden condicionar su estado nutricional y el abordaje del mismo.
Abreviaturas: Ca2+: calcio elemento; EPI: equipo de protección individual; HC: hidratos de carbono; HMB: B-hidroximetilbutirato; K: potasio; MNA-SF: Mini Nutritional Assesment-Short Form; Na: sodio; NE: nutrición enteral; P: fósforo; PCR: Proteína C Reactiva; SNG: sonda nasogástrica; Sat: saturadas; Vit D: vitamina D.
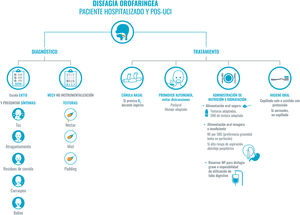
Recomendaciones para el abordaje de la disfagia en el paciente COVID-19 hospitalizado y pos-UCI.
En el abordaje de la disfagia diferenciamos entre el diagnóstico y el tratamiento. Para realizar el diagnóstico nos basaremos en la historia clínica y en el EAT10. Se realizará desde el primer contacto con el paciente, aunque, como no se recomienda el contacto directo en estos casos, se puede valorar utilizar TEST MECV-V en los pacientes seleccionados. Por otra parte, el tratamiento será individualizado y seguro para evitar la generación de aerosoles, y promover la autonomía del paciente.
No se debe olvidar una correcta higiene oral. Recomendamos priorizar la dieta oral, adaptada en composición y texturas; en caso de precisar suplementos se realizará con suplementos específicos de textura adaptada; si la ingesta no es suficiente, se podría plantear el uso de sondas, en estos casos, con abordaje pospilórico. Se reservará la nutrición parenteral para casos severos o con imposibilidad de uso del tubo digestivo.
Abreviaturas: EAT-10: Eating Assessment Tool; MECV: método volumen-viscosidad; NP: nutrición parenteral; O2: oxígeno; SNO: suplemento nutricional oral; SNG: sonda nasogástrica; UCI: unidad de cuidados intensivos.
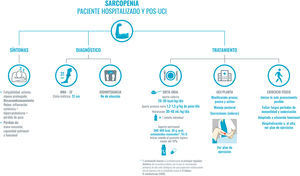
Recomendaciones para el abordaje de la sarcopenia en el paciente COVID-19 hospitalizado y pos-UCI.
El diagnóstico de sarcopenia lo basaremos en la historia clínica. En primer lugar, los síntomas comunes: fatigabilidad, reposo prolongado por astenia, hipoxia o sedación que, junto con el cuadro inflamatorio sistémico, el hipercatabolismo y la pérdida de peso significativa conllevan al desacondicionamiento físico.
Para el diagnóstico, y siguiendo la máxima de evitar en lo posible el contacto con el paciente y/o el uso de material no desechable, se priorizará la puntuación del MNA-SF y el diámetro de la pantorrilla (punto de corte 31 cm, que presenta una buena correlación con la masa libre de grasa y la fuerza muscular), como se indicó en la figura 1. La bioimpedancia no está disponible en la mayor parte de los servicios de Medicina Interna. Si se dispone de ella, se podría usar al ser una técnica sencilla, portátil y fácil de higienizar. Evitaremos técnicas que impliquen un riesgo alto de contagio, como, por ejemplo, el DEXA.
El tratamiento se basa en dos pilares: en la dieta oral y en la movilización precoz del paciente. La dieta oral ha de estar adaptada, tener un alto contenido en proteínas de alta densidad biológica y de alta densidad energética. Si se precisan suplementos nutricionales, se priorizarán aquellos enriquecidos con proteínas de alta densidad biológica, HMB y leucina, como principales reguladores del recambio proteico. En segundo lugar, la movilización precoz del paciente; será pasiva si la incapacidad es severa, o activa, adaptada a la situación funcional de cada paciente.
Abreviaturas: HMB: B-hidroximetilbutirato; MNA-SF: Mini Nutritional Assesment-Short Form; Prot: proteínas; UCI: unidad de cuidados intensivos; Vit. D: vitamina D.
La COVID-19 nos dejará un gran número de personas recuperadas con las mismas condiciones crónicas previas a las que se añadirán las secuelas de la infección, todas ellas susceptibles de empeorar si no ponemos atención en optimizar el estado nutricional del paciente durante su hospitalización y al alta (fig. 2).
Por ello es recomendable tener en cuenta el papel que tienen no sólo las patologías metabólicas crónicas, sino el patrón alimentario30 en la susceptibilidad y en la recuperación de la infección por SARS-CoV-2. En ningún caso podemos olvidarnos del tercer peón de la partida, el ejercicio físico, siempre adaptado a la situación funcional del paciente.
FinanciaciónLos autores declaran que no ha existido financiación externa para la realización de este manuscrito.
Conflicto de interesesEl contenido y las recomendaciones del presente documento se han elaborado con las opiniones de sus autores, sin interferencias de la institución promotora, la Sociedad Española de Medicina Interna (SEMI). Dicha entidad no ha participado en ninguna de las fases del diseño, toma de decisiones o elaboración del material.
A Joana López Corduente y Sergio Carretero Gómez por su ayuda en la elaboración de las infografías.