Describir los predictores de mortalidad en pacientes hospitalizados con síndrome respiratorio agudo severo (SARS) debido a COVID-19 que presentan hipoxemia silente.
Material y métodosEstudio de cohorte retrospectivo de pacientes hospitalizados con SARS debido a COVID-19 e hipoxemia silente al ingreso, en Brasil, de enero a junio de 2021. El resultado principal de interés fue la muerte intrahospitalaria. Se realizó un análisis de regresión logística multivariable.
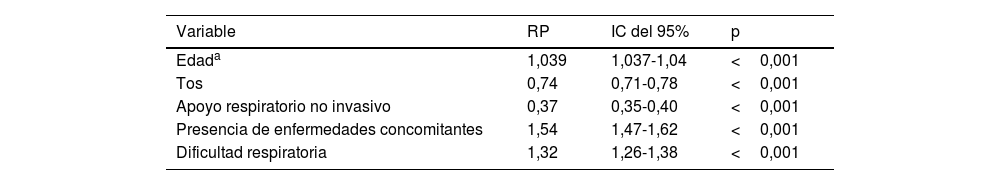
ResultadosDe 46.102 pacientes, la edad media fue de 59±16años, y el 41,6% eran mujeres. Durante la hospitalización fallecieron 13.149 pacientes. En comparación con los sobrevivientes, los no sobrevivientes eran de mayor edad (edad media, 66 vs. 56años; p<0,001), menos frecuentemente mujeres (43,6% hombres vs. 40,9%; p<0,001) y más propensos a tener comorbilidades (74,3% vs. 56,8%; p<0,001). Los no sobrevivientes tuvieron mayores necesidades de ventilación mecánica invasiva (42,4% vs. 6,6%; p<0,001) y admisión a la unidad de cuidados intensivos (56,9% vs. 20%; p<0,001) en comparación con los sobrevivientes. En el análisis de regresión multivariable, la edad avanzada (OR: 1,04; IC del 95%: 1,037-1,04), la presencia de comorbilidades (OR: 1,54; IC del 95%: 1,47-1,62), la tos (OR: 0,74; IC del 95%: 0,71-0,79), la dificultad respiratoria (OR: 1,32; IC del 95%: 1,26-1,38) y la necesidad de soporte respiratorio no invasivo (OR: 0,37; IC del 95%: 0,35-0,40) permanecieron independientemente asociadas con la muerte.
ConclusionesLa edad avanzada, la presencia de comorbilidades y la dificultad respiratoria fueron factores de riesgo independientes para la mortalidad, mientras que la tos y la necesidad de soporte respiratorio no invasivo fueron factores protectores independientes contra la mortalidad en pacientes hospitalizados por SARS debido a COVID-19 con hipoxemia silente en la presentación.
To describe the predictors of mortality in hospitalized patients with severe acute respiratory syndrome (SARS) due to COVID-19 presenting with silent hypoxemia.
Material and methodsRetrospective cohort study of hospitalized patients with SARS due to COVID-19 and silent hypoxemia at admission, in Brazil, from January to June 2021. The primary outcome of interest was in-hospital death. Multivariable logistic regression analysis was performed.
ResultsOf 46,102 patients, the mean age was 59±16years, and 41.6% were female. During hospitalization, 13,149 patients died. Compared to survivors, non-survivors were older (mean age, 66 vs. 56 years; P<0.001), less frequently female (43.6% vs. 40.9%; P<0.001), and more likely to have comorbidities (74.3% vs. 56.8%; P<0.001). Non-survivors had higher needs for invasive mechanical ventilation (42.4% vs 6.6%; P<0.001) and intensive care unit admission (56.9% vs 20%; P<0.001) compared to survivors. In the multivariable regression analysis, advanced age (OR: 1.04; 95%CI: 1.037-1.04), presence of comorbidities (OR: 1.54; 95%CI: 1.47-1.62), cough (OR: 0.74; 95%CI: 0.71-0.79), respiratory distress (OR: 1.32; 95%CI: 1.26-1.38), and need for non-invasive respiratory support (OR: 0.37; 95%CI: 0.35-0.40) remained independently associated with death.
ConclusionsAdvanced age, presence of comorbidities, and respiratory distress were independent risk factors for mortality, while cough and requirement for non-invasive respiratory support were independent protective factors against mortality in hospitalized patients with SARS due to COVID-19 with silent hypoxemia at presentation.
La enfermedad del coronavirus 2019 (COVID-19), una infección causada por el coronavirus del síndrome respiratorio agudo grave de tipo2 (SARS-CoV-2), cursa con una amplia variedad de manifestaciones clínicas, desde infección asintomática hasta enfermedad crítica y mortal1. La mayoría de las infecciones sintomáticas son leves y cursan con fiebre, tos y cansancio2.
Las variaciones en las concentraciones de gases en sangre pueden causar disnea y dificultad respiratoria, que son indicadores cruciales de enfermedad grave3. Según las directrices de los Centros para el Control y la Prevención de Enfermedades, los pacientes con hipoxemia se clasifican como pacientes con enfermedad grave, con necesidad de una asistencia médica más avanzada4. Los pacientes pueden presentar hipoxemia sin disnea, también conocida como hipoxemia silente, no disneica o «feliz»5. En los pacientes que acuden al hospital con la COVID-19 e hipoxemia, la prevalencia de esta manifestación clínica inusual oscila entre el 4,9% y el 31,9%. Dada la definición de hipoxemia silente, es posible que se subestime la prevalencia de esta manifestación grave de la COVID-196,7.
A pesar de su prevalencia y del potencial para un rápido deterioro clínico, los mecanismos patológicos y las implicaciones pronósticas de la hipoxemia silente siguen sin conocerse bien. Esto subraya la necesidad crítica de que las investigaciones epidemiológicas diluciden su prevalencia, los factores de riesgo y la repercusión en los resultados para los pacientes. Los estudios anteriores en los que se evaluó la repercusión de la hipoxemia silente en la COVID-19 se basaron en muestras de tamaño relativamente pequeño, y es posible que su potencia estadística fuera insuficiente para detectar factores de riesgo significativos asociados a resultados clínicos desfavorables6-11. En este contexto, pretendíamos describir las características clínicas y los factores predictivos de mortalidad en una cohorte de pacientes hospitalizados por síndrome respiratorio agudo grave (severe acute respiratory syndrome [SARS]) debido a la COVID-19 que presentaban hipoxemia silente.
Materiales y métodosDiseño del estudio, fuentes de datos, participantes y determinacionesSe trata de un estudio observacional retrospectivo de cohortes. Se extrajeron datos del Sistema de Información de Vigilancia Epidemiológica de la Gripe (Sistema de Informação da Vigilância Epidemiológica da Gripe, SIVEP-Gripe, en portugués), un sistema de información del Ministerio de Sanidad de Brasil que recoge todas las notificaciones de hospitalizaciones por SARS en Brasil, tanto públicas como privadas, del Departamento de Información e Informática del Sistema Único de Salud de Brasil (Departamento de Informação e Informática do Sistema Único de Saúde, DATOS, en portugués), del 1 de enero al 18 de junio de 2021. Las notificaciones se enviaban al sistema en las 24horas posteriores a la sospecha clínica inicial o a la obtención de resultados analíticos positivos. El SARS se definía como disnea, cianosis central, dolor o presión torácica persistente o saturación arterial periférica de oxígeno (SpO2) determinada mediante pulsioximetría <95% en aire ambiental12.
Solo se tuvieron en cuenta los registros de pacientes con diagnóstico confirmado de COVID-19 según las directrices del Ministerio de Sanidad de Brasil12 e hipoxemia silente en el momento de consulta, definida como SpO2 determinada mediante pulsioximetría <95% sin disnea. Se excluyó a las pacientes embarazadas o con estado de embarazo desconocido y a los pacientes con datos ausentes en relación con la SpO2.
Los profesionales sanitarios responsables de la asistencia de los pacientes en el momento del ingreso hospitalario evaluaron y registraron las características iniciales, como signos, síntomas y resultados radiológicos o de tomografías computarizadas (TC). Durante toda la estancia hospitalaria se evaluó la necesidad de apoyo respiratorio, el ingreso en la unidad de cuidados intensivos (UCI) y la mortalidad.
Este estudio cumple las normas éticas de la Declaración de Helsinki para investigaciones en seres humanos. El Comité de Ética de la Escuela de Salud Pública de Ceará aprobó este estudio (número de referencia 49905921.4.0000.5037). No se exigió el consentimiento del paciente para la publicación, ya que los datos se extrajeron de un banco anónimo de acceso público.
Seguimiento y criterios de valoraciónSe hizo un seguimiento de los pacientes durante la hospitalización. El criterio de valoración principal de interés fue la incidencia de muerte.
Análisis estadísticosLos datos categóricos se expresaron como cifras absolutas y porcentajes. Todos los datos cuantitativos se analizaron para determinar su distribución normal mediante la prueba de Kolmogorov-Smirnov. Los datos de distribución normal se expresaron como media y desviación estándar (DE).
Las proporciones de las variables categóricas se compararon mediante la prueba de la ji al cuadrado y la prueba exacta de Fisher, según procediera. Las medias de las variables continuas se compararon mediante la prueba de la t de Student según la distribución normal.
Posteriormente realizamos un análisis de regresión logística multivariante incluyendo variables estadísticamente significativas en análisis bivariante para identificar predictores independientes de mortalidad. El nivel más significativo de las variables correspondientes al criterio de valoración de interés se investigó con el método escalonado progresivo. La presencia de colinealidad entre las variables independientes se exploró mediante la estimación del factor inflación de varianza y de tolerancia antes de incluir modelos multivariante.
Todos los análisis se realizaron con IBM SPSS Statistics for Mac OS, versión 23.0 (IBM Corp., Armonk, N.Y., EE.UU.). Consideramos estadísticamente significativo un valor de p<0,05.
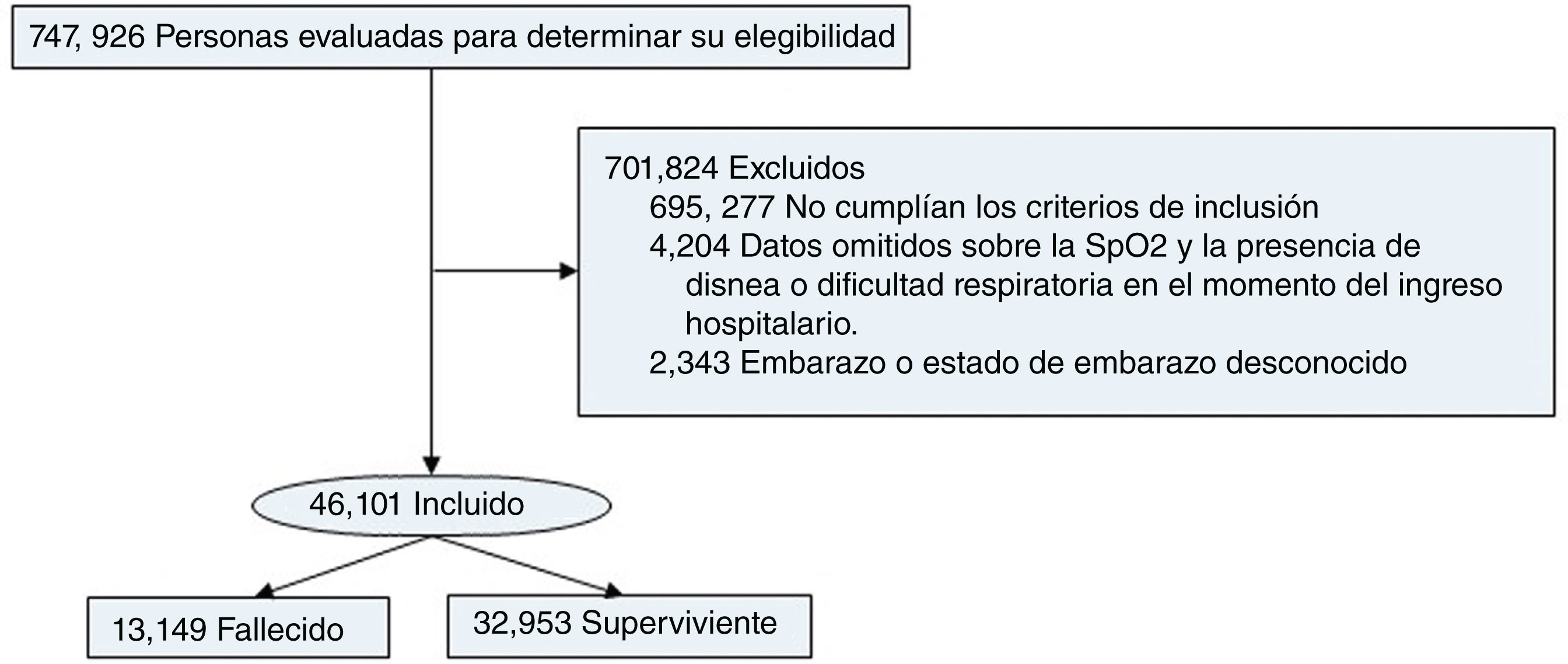
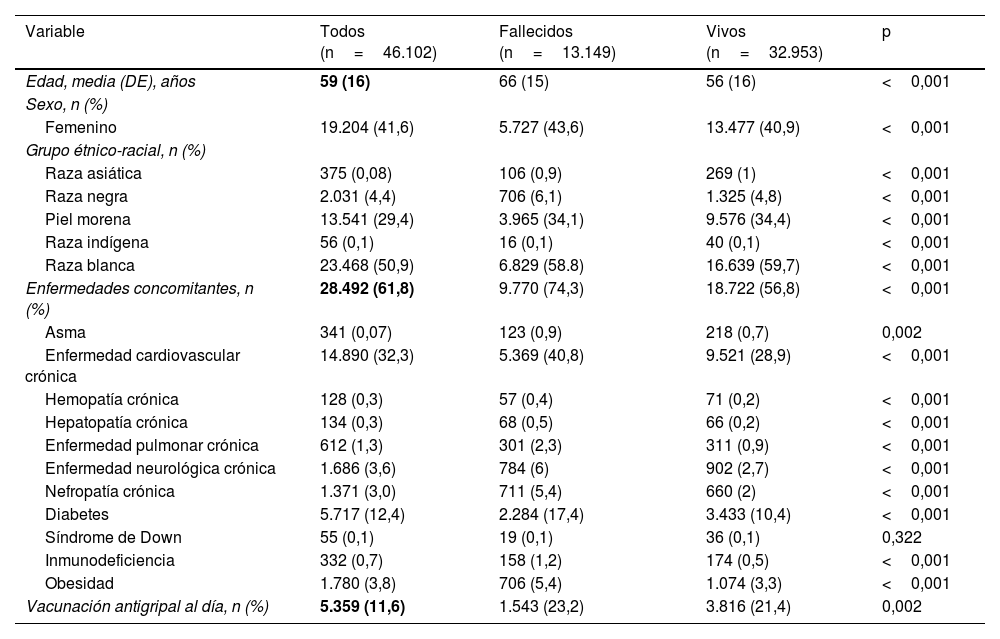
ResultadosCaracterísticas clínicas de la población de pacientesSe seleccionaron 747.926 pacientes entre enero y junio de 2021, y se incluyeron 46.102 pacientes (fig. 1). La media de edad era de 59±16años, 19.204 (41,6%) eran mujeres y 23.428 (50,9%) eran de raza blanca. Las enfermedades concomitantes predominantes fueron enfermedad cardiovascular crónica (14.890 [32,3%]), diabetes (5.717 [12,4%]) y obesidad (1.780 [3,9%]). Los signos y síntomas más frecuentes durante la hospitalización fueron tos (30.951 [67,2%]), dificultad respiratoria (22.496 [48,8%]) y cansancio (11.176 [24,2%]). Los principales hallazgos de estudios de imagen de tórax consistieron en infiltrados intersticiales (6.467 [14%]) y neumonía típica por COVID-19 (22.390 [48,6%]) en las radiografías y TC, respectivamente. La mayoría de los pacientes necesitaron respiración asistida: 30.413 (66%) pacientes necesitaron apoyo no invasivo y 7.762 (16,8%) necesitaron apoyo invasivo. Además, 13.428 (29,1%) pacientes ingresaron en la UCI.
Criterio de valoración principalEl criterio de valoración principal se observó en 13.149 (28,5%) pacientes al final del período de seguimiento.
Análisis univariableEn las tablas 1 y 2 se muestran datos epidemiológicos, demográficos, clínicos, radiológicos y de tratamiento estratificados en función de la presencia del criterio de valoración principal.
Características iniciales estratificadas según el criterio de valoración principal
| Variable | Todos (n=46.102) | Fallecidos (n=13.149) | Vivos (n=32.953) | p |
|---|---|---|---|---|
| Edad, media (DE), años | 59 (16) | 66 (15) | 56 (16) | <0,001 |
| Sexo, n (%) | ||||
| Femenino | 19.204 (41,6) | 5.727 (43,6) | 13.477 (40,9) | <0,001 |
| Grupo étnico-racial, n (%) | ||||
| Raza asiática | 375 (0,08) | 106 (0,9) | 269 (1) | <0,001 |
| Raza negra | 2.031 (4,4) | 706 (6,1) | 1.325 (4,8) | <0,001 |
| Piel morena | 13.541 (29,4) | 3.965 (34,1) | 9.576 (34,4) | <0,001 |
| Raza indígena | 56 (0,1) | 16 (0,1) | 40 (0,1) | <0,001 |
| Raza blanca | 23.468 (50,9) | 6.829 (58.8) | 16.639 (59,7) | <0,001 |
| Enfermedades concomitantes, n (%) | 28.492 (61,8) | 9.770 (74,3) | 18.722 (56,8) | <0,001 |
| Asma | 341 (0,07) | 123 (0,9) | 218 (0,7) | 0,002 |
| Enfermedad cardiovascular crónica | 14.890 (32,3) | 5.369 (40,8) | 9.521 (28,9) | <0,001 |
| Hemopatía crónica | 128 (0,3) | 57 (0,4) | 71 (0,2) | <0,001 |
| Hepatopatía crónica | 134 (0,3) | 68 (0,5) | 66 (0,2) | <0,001 |
| Enfermedad pulmonar crónica | 612 (1,3) | 301 (2,3) | 311 (0,9) | <0,001 |
| Enfermedad neurológica crónica | 1.686 (3,6) | 784 (6) | 902 (2,7) | <0,001 |
| Nefropatía crónica | 1.371 (3,0) | 711 (5,4) | 660 (2) | <0,001 |
| Diabetes | 5.717 (12,4) | 2.284 (17,4) | 3.433 (10,4) | <0,001 |
| Síndrome de Down | 55 (0,1) | 19 (0,1) | 36 (0,1) | 0,322 |
| Inmunodeficiencia | 332 (0,7) | 158 (1,2) | 174 (0,5) | <0,001 |
| Obesidad | 1.780 (3,8) | 706 (5,4) | 1.074 (3,3) | <0,001 |
| Vacunación antigripal al día, n (%) | 5.359 (11,6) | 1.543 (23,2) | 3.816 (21,4) | 0,002 |
DE: desviación estándar.
Los datos categóricos se expresan como cifras absolutas (porcentajes). Los datos cuantitativos se expresan como media ± desviación estándar.
Signos/síntomas, estudios de imagen de tórax y tratamientos estratificados en función del criterio de valoración principal
| Variable | Todos (n=46.102) | Fallecidos (n=13.149) | Vivos(n=32.953) | p |
|---|---|---|---|---|
| Signos y síntomas, n (%) | ||||
| Dolor abdominal | 3.002 (6,5) | 768 (6) | 2.234 (6,9) | <0,001 |
| Anosmia | 4.935 (10,7) | 992 (7,7) | 3.943 (12,2) | <0,001 |
| Tos | 30.951 (67,1) | 7.966 (60,9) | 22.985 (70) | <0,001 |
| Diarrea | 7.710 (16,7) | 1.927 (14,9) | 5.783 (17,7) | <0,001 |
| Disgeusia | 5.307 (11,5) | 1.113 (8,7) | 4.194 (13) | <0,001 |
| Fatiga | 11.176 (24,2) | 2.819 (21,9) | 8.357 (25,9) | <0,001 |
| Dificultad respiratoriaa | 22.496 (48,8) | 6.901 (52,8) | 15.595 (47,6) | <0,001 |
| Dolor de garganta | 7.126 (15,4) | 1.714 (13,2) | 5.412 (16,6) | <0,001 |
| Vómitos | 4.623 (10) | 1.181 (9,1) | 3.442 (10,6) | <0,001 |
| Resultados de la radiografía de tórax, n (%) | ||||
| Consolidación | 626 (1,3) | 274 (3,3) | 352 (1,7) | <0,001 |
| Infiltrados intersticiales | 6.467 (14) | 1.985 (23,6) | 4.482 (21,5) | <0,001 |
| Patrón mixto | 725 (1,6) | 249 (3) | 476 (2,3) | <0,001 |
| Normal | 907 (2) | 266 (3,2) | 641 (3,1) | <0,001 |
| Otros | 2.250 (4,9) | 712 (8,5) | 1.538 (7,4) | <0,001 |
| No realizado | 18.312 (39,7) | 4.930 (58,6) | 13.382 (64,1) | <0,001 |
| Resultados de la TC de tórax, n (%) | ||||
| Patrón atípico de COVID-19 | 421 (0,9) | 124 (1,3) | 297 (1,2) | <0,001 |
| Patrón típico de COVID-19 | 22.390 (48,6) | 5.799 (61) | 16.591 (67,1) | <0,001 |
| Patrón indeterminado de COVID-19 | 948 (2) | 325 (3,4) | 623 (2,5) | <0,001 |
| Normal | 85 (0,2) | 19 (0,2) | 66 (0,3) | <0,001 |
| Otros | 1.790 (3,9) | 381 (4) | 1.409 (5,7) | <0,001 |
| No realizado | 8.590 (18,6) | 2.864 (30,1) | 5.726 (23,2) | <0,001 |
| Necesidad de apoyo respiratorio, n (%) | ||||
| Ninguno | 7.927 (17,2) | 1.146 (8,7) | 6.781 (20,6) | <0,001 |
| No invasivo | 30.413 (66) | 6.429 (48,9) | 23.984 (72,8) | <0,001 |
| Invasivo | 7.762 (16,3) | 5.574 (42,4) | 2.188 (6,6) | <0,001 |
| Necesidad de ingreso en la UCI, n (%) | 13.428 (29,1) | 7.128 (56,9) | 6.300 (20) | <0,001 |
TC: tomografía computarizada; UCI: unidad de cuidados intensivos.
En comparación con los pacientes que sobrevivieron, los que fallecieron se caracterizaron por tener una edad avanzada (media de edad, 66 [DE: 15] frente a 56años [DE: 16]; p<0,001), menor frecuencia de sexo femenino (43,6% mujeres frente al 56,4% varones; p<0,001) y, predominantemente, raza negra (6,1% frente al 4,8%; p<0,001). Proporcionalmente, los individuos de raza negra y piel morena registraron tasas de mortalidad más altas (53,3% y 41,4%, respectivamente).
Las probabilidades de presentar una o más enfermedades concurrentes fue significativamente mayor para los pacientes que murieron que para los que sobrevivieron (74,3% frente al 56,8%; p<0,001). De esas enfermedades concomitantes, la enfermedad cardiovascular crónica (40,8% frente al 28,9%; p<0,001), hemopatía crónica (0,4% frente al 0,2%; p<0,001), enfermedad neurológica crónica (6% frente al 2,7%; p<0,001), hepatopatía crónica (0,5% frente al 0,2%; p<0,001), enfermedad pulmonar crónica (2,3% frente al 0,9%; p<0,001), nefropatía crónica (5,4% frente al 2%; p<0,001), diabetes (17,4% frente al 10,4%; p<0,001), inmunodeficiencia (1,2% frente al 0,5%; p<0,001) y obesidad (5,4% frente al 3,3%; p<0,001) se asociaron significativamente a mortalidad.
En cuanto al estado de vacunación contra la gripe, los pacientes fallecidos registraron tasas significativamente mayores de vacunación al día (23,2% frente al 21,4%; p=0,002) que los supervivientes.
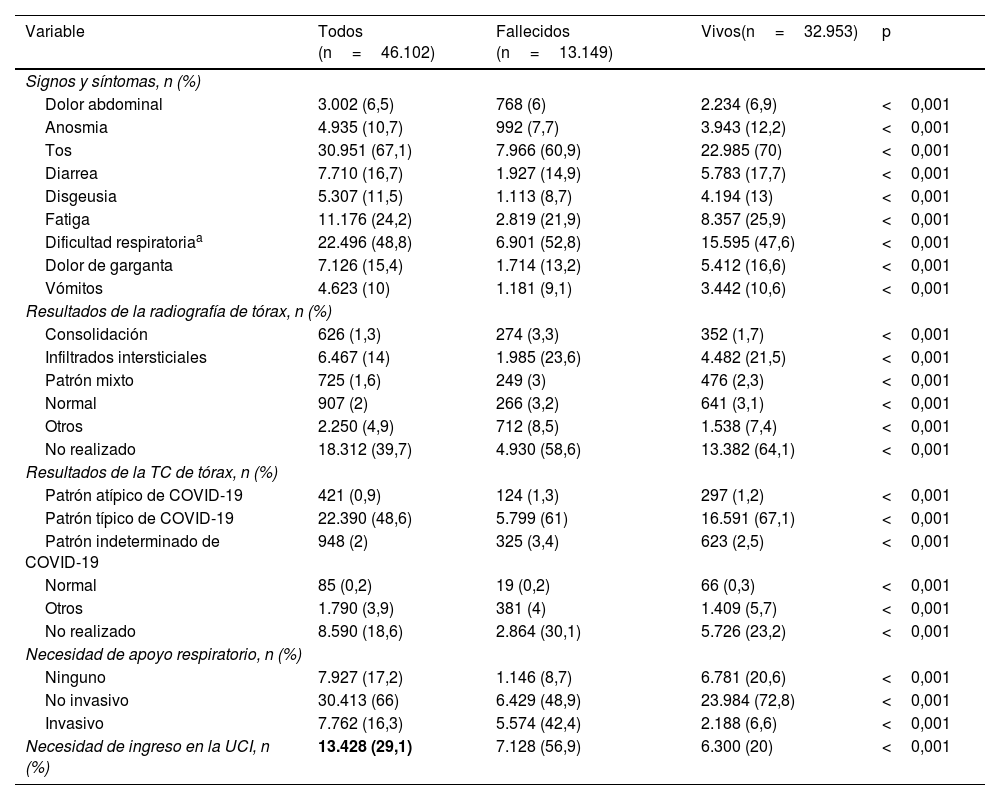
Durante la hospitalización, los pacientes que fallecieron presentaron tasas significativamente mayores de dificultad respiratoria (52,8% frente al 47,6%; p<0,001) que los que sobrevivieron. Sin embargo, la anosmia (7,7% frente al 12,2%; p<0,001), la tos (60,9% frente al 70%; p<0,001), la diarrea (14,9% frente al 17,7%; p<0,001), la disgeusia (8,7% frente al 13%; p<0,001), la fatiga (21,9% frente al 25,9%; p<0,001) y el dolor de garganta (13,2% frente al 16,6%; p<0,001) fueron relativamente menos frecuentes.
En comparación con los supervivientes, los no supervivientes tenían significativamente menos probabilidades de presentar cambios en los estudios de imagen de tórax, excepto el patrón típico de la COVID-19 (61% frente al 67,1%; p<0,001). Sin embargo, una proporción considerable de pacientes no se sometió a estudios de imagen de tórax (39,7% en el caso de las radiografías y 18,6% en el de las TC de tórax).
En lo que respecta al apoyo respiratorio, los no supervivientes tuvieron una necesidad significativamente mayor de ventilación mecánica invasiva (42,4% frente al 6,6%; p<0,001) que los supervivientes. Por el contrario, la ausencia de apoyo respiratorio (8,7% frente al 20,6%; p<0,001) y la necesidad de apoyo respiratorio no invasivo (48,9% frente al 72,8%; p<0,001) fueron significativamente menos probables entre los no supervivientes.
Por último, los ingresos en la UCI se asociaron significativamente a mortalidad (56,9% frente al 20%; p<0,001).
Análisis multivarianteEn el análisis multivariante (tabla 3), la edad avanzada (razón de posibilidades [RP]: 1,04; intervalo de confianza [IC] del 95%: 1,037-1,04; p<0,001), la presencia de enfermedades concomitantes (RP: 1,54; IC del 95%: 1,47-1,62; p<0,001), la tos (PR: 0,74; IC del 95%: 0,71-0,79; p<0,001), la dificultad respiratoria (RP: 1,32; IC del 95%: 1,26-1,38; p<0,001) y la necesidad de apoyo respiratorio no invasivo (RP: 0,37; IC del 95%: 0,35-0,40; p<0,001) siguieron estando independientemente asociadas a la muerte.
Análisis multivariante del criterio de valoración principal
| Variable | RP | IC del 95% | p |
|---|---|---|---|
| Edada | 1,039 | 1,037-1,04 | <0,001 |
| Tos | 0,74 | 0,71-0,78 | <0,001 |
| Apoyo respiratorio no invasivo | 0,37 | 0,35-0,40 | <0,001 |
| Presencia de enfermedades concomitantes | 1,54 | 1,47-1,62 | <0,001 |
| Dificultad respiratoria | 1,32 | 1,26-1,38 | <0,001 |
IC: intervalo de confianza; RP: razón de posibilidades.
Riesgo por cada año adicional de edad.
En total, se introdujeron 15 variables en el modelo multivariante. Las 15 variables fueron: edad, sexo, presencia de enfermedades concomitantes, necesidad de apoyo respiratorio no invasivo, hepatopatía crónica, enfermedad neurológica crónica, enfermedad pulmonar crónica, diabetes, obesidad, tos, dificultad respiratoria, fatiga, anosmia, diarrea y fiebre. Se muestran las cinco variables iniciales, consideradas de suma importancia.
En este estudio de cohortes retrospectivo se evaluaron las características clínicas y los factores predictivos de muerte en pacientes hospitalizados por SARS a causa de la COVID-19 que presentaban hipoxemia silente en el momento del ingreso. Los principales hallazgos fueron que a)la edad avanzada, la presencia de enfermedades concomitantes y la presencia de dificultad respiratoria eran factores de riesgo independientes para la mortalidad, mientras que b)la presencia de tos y la necesidad de apoyo respiratorio no invasivo eran factores protectores independientes frente a la mortalidad.
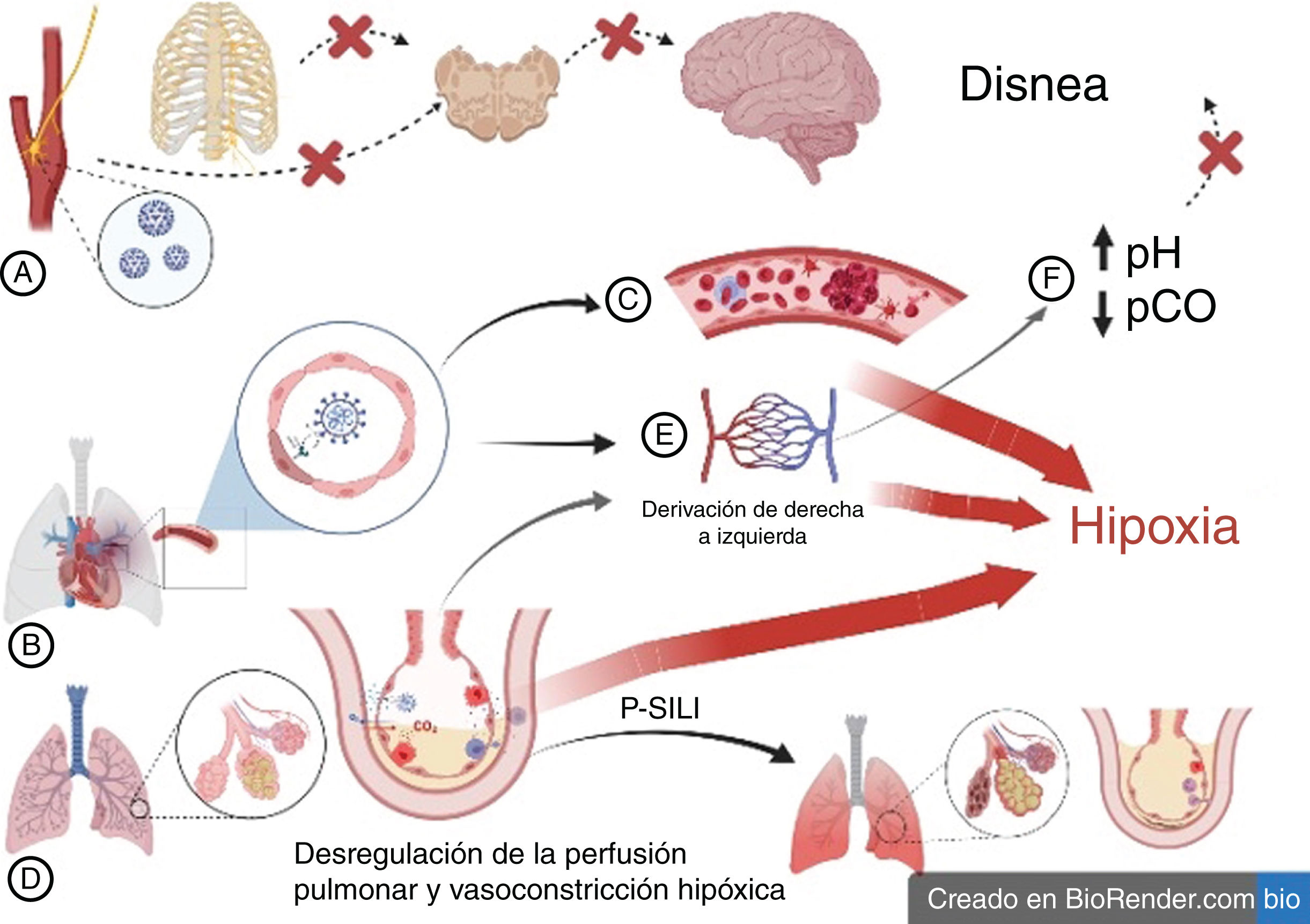
Se han propuesto varios mecanismos para explicar la hipoxemia silente en la COVID-19. Gattinoni et al. propusieron dos «fenotipos» principales: tipos L y H. El tipo L, caracterizado por una elastancia baja y un cociente ventilación-perfusión (V/Q) reducido, es consecuencia de edema intersticial local inducido por virus y vasoplejía13-15. Los pacientes con el tipo L carecen de disnea debido a una distensibilidad casi normal16-19. La transición al tipo H, motivada por una mayor intensidad e inflamación de la COVID-19, puede inducir disnea a través de una lesión pulmonar autoinfligida (P-SILI)13,20. Esto refleja las condiciones observadas en el síndrome de dificultad respiratoria aguda16,21,22.
En la COVID-19, la ausencia de disnea puede atribuirse a una lesión vírica directa de los cuerpos carotídeos y el tracto solitario, ya que las células del glomo carotídeo presentan niveles elevados de expresión del receptor SARS-CoV-2, la enzima convertidora de la angiotensina18,19,23-27. El síndrome vascular agudo (SVA), resultante de disfunción endotelial, formación de microtrombos en la vasculatura pulmonar y proliferación vascular en los pulmones, causa una elevación del flujo vascular pulmonar, lo que da lugar a una derivación intrapulmonar significativa de derecha a izquierda27,28. Además, la variabilidad de la respuesta ventilatoria hipóxica en diferentes poblaciones no solo explica la elevada prevalencia de hipoxemia silente, sino que también indica que este fenómeno podría estar presente en otras causas de hipoxia, como la neumonía gripal, entre otras (fig. 2)16.
Mecanismos propuestos de hipoxia silente en la COVID-19.
A) La infección vírica directa de los cuerpos carotídeos y del sistema nervioso central puede reducir la percepción de disnea mediada por quimiorreceptores. B)La disfunción de las células endoteliales puede precipitar un síndrome vascular agudo. Esto favorece la formación de microtrombos en la vasculatura pulmonar (C) e induce la proliferación vascular en los pulmones. En consecuencia, esta cascada puede culminar en el desarrollo de una derivación intrapulmonar de derecha a izquierda (D). E)La desregulación de la perfusión pulmonar y la vasoconstricción hipóxica también podrían contribuir a la derivación de derecha a izquierda (D). F)La alcalosis respiratoria y la hipocapnia amortiguan los estímulos ventilatorios y la sensación de disnea.
P-SILI: lesión pulmonar autoinfligida por el paciente.
Hasta donde sabemos, este estudio es la mayor cohorte de hipoxemia silente en la COVID-19 hasta la fecha. La edad avanzada y la presencia de enfermedades concomitantes surgieron como factores predictivos independientes y significativos de resultados adversos, en consonancia con investigaciones previas. Cabe destacar que en un metaanálisis exhaustivo en el que se evaluó el efecto aislado de la edad sobre el riesgo de resultados graves en los pacientes con COVID-19, los riesgos de hospitalización, mortalidad intrahospitalaria y mortalidad global aumentaron en un 3,4%, un 5,7% y un 7,4% por año de edad, respectivamente. Estos criterios de valoración subrayan el aumento continuo, relacionado con la edad, de la sensibilidad a los acontecimientos adversos asociados a la infección por el SARS-CoV-21,3,29-32. Además, la asociación de enfermedades concomitantes, como enfermedad cardiovascular, diabetes y obesidad, con la COVID-19 grave subraya la importancia de tener en cuenta el estado de salud subyacente en la estratificación del riesgo y las estrategias de tratamiento clínico para los pacientes con hipoxemia silente33-35. En nuestra cohorte, los supervivientes eran generalmente más sintomáticos y presentaban diversos síntomas, como anosmia, tos, diarrea, disgeusia, cansancio y dolor de garganta. Estos síntomas pueden haber llevado a los pacientes a solicitar asistencia médica en una fase temprana de la enfermedad, lo que aumenta las probabilidades de recibir apoyo respiratorio oportuno. Esta intervención inmediata podría haber contribuido a disminuir la P-SILI, atenuando la gravedad del compromiso respiratorio y, en último término, mejorando los resultados de los pacientes.
En particular, la aparición de tos y la necesidad de apoyo respiratorio no invasivo emergen como factores protectores contra la mortalidad. Estos resultados subrayan la importancia de la identificación precoz de los pacientes hipoxémicos. La identificación oportuna de síntomas como la tos y el inicio inmediato de medidas de apoyo respiratorio apropiadas podrían mejorar significativamente los resultados para los pacientes y reducir las tasas de mortalidad en la COVID-19.
En un metaanálisis en el que se investigaron la prevalencia y los resultados para los pacientes con COVID-19 con hipoxia silente, Bepouka et al. demostraron una tasa de mortalidad del 1% al 45,4%, con una mortalidad agrupada del 2%36. En nuestra cohorte, la mortalidad fue notablemente mayor, del 28,5%. Esta disparidad podría deberse a variaciones en las características demográficas de los pacientes, la gravedad de la enfermedad, los sistemas sanitarios y las definiciones de hipoxemia silente entre los estudios.
Entre los pacientes no disneicos con COVID-19, aproximadamente un tercio pueden manifestar hipoxemia en el momento del ingreso, lo que los señala como un subgrupo de casos graves que requieren una identificación precoz37,38. La pulsioximetría surge como herramienta fundamental en este contexto, ofreciendo un medio sencillo, no invasivo y ampliamente accesible de evaluación de la saturación arterial de oxígeno39,40. A pesar de posibles factores de confusión, como sesgo racial, vasoconstricción, hipoxemia y la propia COVID-19, que pueden influir en la exactitud de la determinación de la SpO2 y la correlación entre la SpO2 y la oxigenación arterial, la integración de los pulsioxímetros es crucial para el cribado de los pacientes con COVID-1941,42. En este grupo específico de pacientes no disneicos, la evaluación inicial de la SpO2 por medio de la pulsioximetría reviste especial importancia, ya que permite la detección precoz de la hipoxia silente, facilita la intervención oportuna y mejora en última instancia los resultados37,43,44. Además, las evaluaciones clínicas deben hacer hincapié en la vigilancia de la evolución de los signos y síntomas, especialmente de la frecuencia respiratoria, para detectar rápidamente cualquier deterioro16,45. Este enfoque integral garantiza una estrategia de tratamiento proactiva y eficaz en esta cohorte específica, lo que contribuye a mejorar la asistencia de los pacientes y el pronóstico global.
En lo que respecta al cribado de la gravedad de la enfermedad en el ámbito ambulatorio, está claro que la utilización exclusiva de los síntomas comunicados por los pacientes no sería una estrategia exacta y exhaustiva debido a la existencia de presentaciones hipoxémicas no disneicas. Esto debería justificar la utilización de criterios más objetivos, como la gasometría arterial y la pulsioximetría. A tenor de estos resultados, proponemos que, cuando sea posible, los pacientes con COVID-19 deben someterse a un cribado oportuno de hipoxemia, con independencia de los síntomas, mediante pulsioximetría para evaluar la hipoxemia silente y la consiguiente necesidad de apoyo respiratorio y tratamientos farmacológicos disponibles.
Al proporcionar apoyo respiratorio a los pacientes con hipoxemia silente —que se cree que está relacionada con el fenotipo L—, el objetivo principal debe ser prevenir la P-SILI y aumentar la fracción respiratoria de oxígeno. La aplicación de una estrategia de apoyo respiratorio precoz a estos pacientes podría reducir el riesgo de P-SILI y, en consecuencia, mitigar la progresión de la enfermedad.
LimitacionesEste estudio tiene limitaciones. En primer lugar, utilizamos registros administrativos a partir de formularios de vigilancia estructurados, lo que puede conllevar limitaciones inherentes debido a su dependencia de categorías predefinidas y entrada de datos normalizada. En segundo lugar, no todos los casos de COVID-19 se notifican en Brasil. La infranotificación podría influir en la generalización de los resultados del estudio. En tercer lugar, se excluyó del análisis a los pacientes con datos omitidos sobre la SpO2 y la presencia de disnea o dificultad respiratoria en el momento del ingreso hospitalario. En cuarto lugar, dado que nuestro estudio se realizó a principios de 2021, era poco probable incluir a pacientes con la variante de Ómicron y sus sublinajes. Por tanto, es esencial seguir investigando específicamente a los pacientes infectados por estas variantes. En quinto lugar, la ausencia de datos disponibles sobre los resultados analíticos, incluida la gasometría arterial, que podrían utilizarse para analizar mejores alteraciones de la gasometría y que podrían interferir en la evolución clínica, como hipocapnia e hipercapnia, limitó nuestras consideraciones. En sexto lugar, los datos limitados sobre el tiempo transcurrido desde el inicio de los síntomas hasta la presentación inicial y la duración del seguimiento dificultan una evaluación precisa de la evolución clínica del paciente y del impacto de la intervención médica retardada. Por tanto, está justificado realizar más estudios con datos exhaustivos relacionados con el tiempo para conocer mejor la evolución clínica de la hipoxemia asintomática en la COVID-19.
ConclusionesEn este estudio de cohortes multicéntrico de 46.102 pacientes hospitalizados por SARS debido a COVID-19 con hipoxemia silente en el momento de consulta en Brasil, la edad avanzada, la presencia de enfermedades concomitantes y la aparición de dificultad respiratoria fueron factores de riesgo independientes de mortalidad. A la inversa, la aparición de tos y la necesidad de apoyo respiratorio no invasivo fueron factores protectores independientes contra la mortalidad.
FinanciaciónEste estudio fue patrocinado por el Consejo Brasileño de Desarrollo Científico y Tecnológico (Conselho Nacional de Desenvolvimento Científico e Tecnológico [CNPq]) y por la Coordinación para la Mejora del Personal de Educación Superior (Coordenação de Aperfeiçoamento de Pessoal de Nível Superior [CAPES]). Las fuentes de financiación no participaron en el diseño del estudio, la recopilación, la gestión, el análisis y la interpretación de los datos, ni en la preparación, la revisión y la aprobación de este artículo.
Declaración de disponibilidad de datosTodos los datos pertinentes para el estudio se incluyen en el artículo o se cargan como información complementaria.
Conflictos de interesesLos autores han declarado que no tienen conflictos de intereses.
Este trabajo ha sido realizado por la Universidad Federal de Ceará, Fortaleza, CE (Brasil).