Protocolos para el manejo de la Enfermedad Tromboembólica Venosa
Más datosLa trombosis venosa profunda (TVP) forma parte del espectro clínico de la enfermedad tromboembólica venosa (ETV), cuya incidencia anual se estima en 1-2 episodios por 1.000 personas y constituye la tercera causa de mortalidad cardiovascular en los países desarrollados.
Establecer un diagnóstico certero de la TVP es primordial para evitar complicaciones agudas, como la embolia pulmonar, y crónicas asociadas al síndrome postrombótico. Actualmente están bien establecidos los algoritmos diagnósticos para la TVP de las extremidades inferiores. Estos incluyen modelos de probabilidad clínica, que permiten establecer el riesgo de presentar la enfermedad con base en los antecedentes del paciente y en hallazgos clínicos, la determinación del dímero D, producto de degradación de la fibrina con un elevado valor predictivo negativo, y pruebas de imagen para confirmar el diagnóstico.
La ecografía venosa por compresión es la técnica de elección en la actualidad, al tratarse de una prueba no invasiva de fácil realización y que permite evaluaciones seriadas. Hay mucha evidencia acumulada de que en pacientes con baja o intermedia probabilidad clínica y un dímero D negativo (< 500 ng/ml) se puede excluir de forma segura el diagnóstico de TVP sin exploraciones adicionales. No hay un consenso tan claro sobre la necesidad de una exploración proximal o completa de toda la extremidad. Otras técnicas también pueden ser utilizadas, como la venografía por resonancia magnética o la tomografía axial computarizada en fase venosa, aunque estas no deben sustituir a la ecografía de compresión como primera prueba diagnóstica. Hay otras circunstancias especiales en las que el diagnóstico es más problemático y no existen algoritmos diagnósticos tan consolidados, como la TVP durante el embarazo, el diagnóstico de una retrombosis o la TVP que afecta a las extremidades superiores.
Deep vein thrombosis (DVT) is part of the clinical spectrum of venous thromboembolism disease (VTE), whose estimated annual incidence rate is 1-2 episodes per 1000 individuals and represents the third leading cause of cardiovascular mortality in developed countries.
Establishing an accurate diagnosis of DVT is essential for preventing acute complications (such as pulmonary embolism) and chronic complications associated with post-thrombotic syndrome. Currently, there are well-established diagnostic algorithms for lower extremity DVT, which include clinical probability models that help establish the risk of experiencing the disease based on the patients’ history, clinical findings, D dimer measurements, fibrin degradation product tests with a high negative predictive value and imaging tests to confirm the diagnosis.
Venous compression ultrasonography is currently the technique of choice because it is a non-invasive, easy-to-administer test that can make serial evaluations. There is much accumulated evidence that DVT can be safely ruled out in patients with a low or intermediate clinical probability and a negative D dimer (<500 ng/mL) without performing additional examinations. The consensus is not as clear about the need for a proximal or complete examination of the entire extremity. Other techniques may also be employed, such as magnetic resonance venography and venous phase computed axial tomography, although these should not be a substitute for compression ultrasonography as the initial diagnostic test. There are other special circumstances in which the diagnosis is more problematic and there are no diagnostic algorithms as consolidated, such as DVT during pregnancy, diagnosing rethrombosis and DVT that affects the upper extremities.
La trombosis venosa profunda (TVP) y la embolia pulmonar constituyen el espectro clínico de la enfermedad tromboembólica venosa (ETV). La ETV tiene una incidencia anual de 1-2 episodios por cada 1.000 personas1 de la población general y una elevada morbimortalidad, y es la tercera causa de mortalidad cardiovascular en nuestro país tras el infarto agudo de miocardio y el ictus. Esta mortalidad es superior entre los pacientes con embolia pulmonar2. Por ello, establecer un diagnóstico adecuado de TVP es primordial. Un retraso diagnóstico puede suponer mayores complicaciones a corto plazo en forma de embolia pulmonar y a largo plazo en forma de síndrome postrombótico. Su diagnóstico no puede basarse solo en las manifestaciones clínicas de la enfermedad y desde hace años están bien establecidos los algoritmos basados en escalas de probabilidad clínica, determinación del dímero D (DD) y pruebas de imagen, sobre todo la ecografía venosa de compresión. Desde la última actualización de los protocolos en 2009 sobre la ETV, ha aparecido suficiente evidencia sobre la validez y utilidad clínica de estos algoritmos diagnósticos, aunque existen todavía ciertas áreas de incertidumbre, en concreto, en los pacientes de edad avanzada, el embarazo y el diagnóstico de una nueva TVP en pacientes con trombosis previa en la misma extremidad3.
Estrategias de cribadoEscalas de probabilidad clínicaLa TVP debemos sospecharla ante un paciente que presenta edema con aumento del diámetro de la extremidad, enrojecimiento y dolor, sobre todo cuando la afectación es unilateral. Estas manifestaciones clínicas, aunque características de la enfermedad, son inespecíficas y plantean un amplio diagnóstico diferencial, que puede incluir rotura fibrilar, insuficiencia venosa, linfedema, celulitis o quiste de Baker4. Entre todos los hallazgos clínicos, el que parece que podría tener más utilidad es el aumento del diámetro de la pantorrilla, tanto para establecer el diagnóstico como para excluirlo.
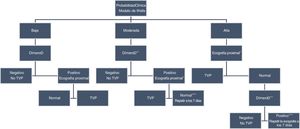
De todas formas, la asociación entre hallazgos clínicos, factores de riesgo y antecedentes del paciente resulta más útil ante la sospecha de TVP. En este sentido, un metaanálisis mostró que la presencia de cáncer, de TVP previa, la reciente inmovilización o la cirugía y diferencias en el diámetro de la pantorrilla eran útiles para establecer el diagnóstico5. Las escalas de probabilidad clínica recogen todos estos factores y permiten estratificar el riesgo de una TVP. Han aparecido diversas escalas en los últimos años, pero la escala de Wells6 sigue siendo la mejor validada y más utilizada. En el estudio original los pacientes con sospecha de TVP fueron categorizados en baja, intermedia y alta probabilidad con una prevalencia del 3, 17 y del 75% de TVP confirmada. Posteriormente esta misma escala fue modificada para clasificar a los pacientes en 2categorías, según fuese probable o improbable el diagnóstico7 (tabla 1). Los autores confirmaron que en pacientes con baja probabilidad y negatividad del DD se podía excluir de forma segura el diagnóstico de TVP sin necesidad de exploraciones adicionales, con una incidencia del 0,4% de episodios tromboembólicos venosos en los siguientes 3 meses. Estudios posteriores han demostrado que ambas escalas son igual de útiles en el diagnóstico de la TVP proximal8, aunque tienen limitaciones en la TVP distal y en los pacientes hospitalizados9,10. Recientemente ha sido publicado un nuevo modelo de estratificación del riesgo en pacientes hospitalizados que incluye 4 variables: TVP previa, cáncer activo, hospitalización ≥6 días y edad ≥46 años. La ausencia de cualquiera de estas variables identificaba a pacientes de bajo riesgo, con una incidencia de TVP proximal del 2,9% respecto al 12% en pacientes de alto riesgo11. De todas formas, se requieren más estudios para analizar su utilidad clínica en este subgrupo de pacientes. A pesar de las posibles limitaciones, las diferentes guías aparecidas en los últimos años recomiendan iniciar el proceso diagnóstico con las escalas de probabilidad clínica12-14.
Modelo clínico de Wells
| Características clínicas | Valor |
|---|---|
| Cáncer activo (paciente que recibió quimioterapia en los 6 meses previos o en tratamiento paliativo) | 1 |
| Parálisis, paresia o inmovilización con yeso de una extremidad | 1 |
| Reciente encamamiento durante 3 días o más, o cirugía mayor en las 12 semanas previas con anestesia general o regional | 1 |
| Dolor a la presión a lo largo de la distribución del sistema venoso profundo | 1 |
| Tumefacción de toda la extremidad | 1 |
| Aumento del perímetro mayor de 3cm respecto a la extremidad asintomática, medido 10cm por debajo de la tuberosidad tibial | 1 |
| Edema en la extremidad sintomática | 1 |
| Venas superficiales colaterales no varicosas | 1 |
| Trombosis venosa profunda previa | 1 |
| Diagnóstico alternativo al menos tan probable como la trombosis venosa profunda | −2 |
< 1: probabilidad baja; 1-2: probabilidad intermedia; ≥3: probabilidad alta.
< 2: improbable; ≥2: probable.
El DD es un producto de degradación de la fibrina que se eleva en la fase aguda de la TVP. Es un parámetro altamente sensible pero muy inespecífico, ya que también se incrementa en otras muchas situaciones (tabla 2). Su utilidad en el proceso diagnóstico de la TVP radica en su elevado valor predictivo negativo. Ello permite excluir la TVP en pacientes con baja o intermedia probabilidad clínica12,13. Existen diferentes técnicas disponibles para la determinación del DD que pueden variar respecto de la sensibilidad y el médico debe estar familiarizado con la utilizada por su laboratorio. En general, pueden ser técnicas cuantitativas, semicuantitativas o cualitativas y respecto a su sensibilidad se pueden dividir en aquellas muy sensibles (> 90%) y con el valor predictivo negativo más elevado, como ELISA, ELISA rápido o inmunoturbidimétricas, y otras técnicas con una sensibilidad intermedia (80-90%), como las técnicas de aglutinación de partículas de látex o de hematíes15. Estas últimas solo ayudan a excluir el diagnóstico de TVP en pacientes con baja probabilidad clínica y no es recomendable su uso en pacientes con moderada o alta probabilidad clínica12,13. Aunque puede variar dependiendo de la técnica, el punto de corte habitual es < 500 ng/ml. Existen diferentes situaciones en las que hay que valorar con cautela el DD. Una de ellas es el embarazo, porque se produce un incremento progresivo del nivel del DD, que alcanza el máximo en el momento del parto y durante el puerperio. Así, en un estudio reciente con mujeres sanas embarazadas se observó que la totalidad de la población tenía niveles de DD> 500 ng/ml entre las semanas 36 y 4216. Se desconoce cuál es el punto de corte que nos permita excluir el diagnóstico de TVP y, en consecuencia, no se recomienda su uso. El valor del DD también se incrementa con la edad, sobre todo en pacientes mayores de 80 años. Si se utiliza el punto de corte convencional en esta población se incrementa la proporción de falsos positivos y la necesidad de exploraciones adicionales. En los últimos años se ha introducido un punto de corte ajustado a la edad calculado como edad×10 ng/ml. De esta forma se consigue incrementar la especificidad de la prueba manteniendo su elevada sensibilidad y, en consecuencia, reducir el número de técnicas de imagen necesarias para excluir la TVP en pacientes ancianos con baja probabilidad clínica17,18. Por último, la utilidad del DD en pacientes hospitalizados también es limitada porque, aunque ha demostrado tener una elevada sensibilidad y valor predictivo negativo19, los falsos positivos debidos a las condiciones propias de la hospitalización (cirugía, cáncer, sepsis, insuficiencia cardiaca…) obligan a un mayor número de exploraciones para excluir el diagnóstico de TVP.
Enfermedades asociadas con un incremento de los niveles plasmáticos del DD:
| Enfermedades trombóticas arteriales: |
| Infarto agudo de miocardio |
| Ictus |
| Isquemia arterial aguda de las extremidades |
| Fibrilación auricular rápida |
| Trombo intracardiaco |
| Enfermedad tromboembólica venosa: |
| Trombosis venosa profunda |
| Embolia pulmonar |
| Coagulación intravascular diseminada |
| Embarazo: |
| Embarazo normal |
| Preeclampsia y eclampsia |
| Insuficiencia cardiaca congestiva |
| Infección grave o sepsis |
| Cirugía o traumatismos graves |
| Síndrome de respuesta inflamatoria sistémica |
| Enfermedades neoplásicas |
| Insuficiencia hepática grave |
| Enfermedades renales: |
| Enfermedad renal crónica |
| Insuficiencia renal aguda |
| Síndrome nefrótico |
| Alteraciones de la fibrinólisis; uso de fármacos trombolíticos |
| Episodios vasoclusivos en la anemia de células falciformes |
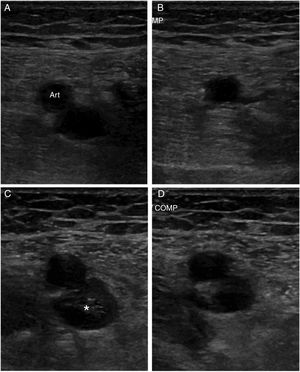
La flebografía se ha considerado históricamente como la técnica de referencia para el diagnóstico de la TVP, pero ahora está en desuso debido a que se trata de una prueba invasiva, dolorosa y no exenta de complicaciones. En la actualidad existe un amplio consenso en que la primera prueba ante la sospecha de una TVP es la ecografía venosa20. El principal criterio diagnóstico es la falta de compresión del segmento venoso explorado (fig. 1). Es una técnica no invasiva que permite evaluaciones seriadas. Tiene una elevada sensibilidad (94,2%) y especificidad (93,8%) para el diagnóstico de TVP proximal en las extremidades inferiores, aunque su sensibilidad disminuye de forma considerable cuando se trata de TVP distal (63,5%)21 o en pacientes asintomáticos (59%)22. Otra limitación es la evaluación de segmentos venosos no compresibles, como las venas ilíacas o el segmento proximal de la vena subclavia en las extremidades superiores. La adición del sistema doppler-color no mejora el rendimiento diagnóstico de la prueba cuando se trata de una TVP proximal, pero es útil en la identificación de las venas distales de la extremidad inferior, así como en la evaluación de venas no compresibles. Además, ayuda a caracterizar mejor el tipo de trombosis al diferenciar entre oclusión total o parcial20. Por otro lado, no hay un consenso tan claro sobre la necesidad de una ecografía proximal (hasta el hueco poplíteo) o completa de toda la extremidad. La primera modalidad no permite diagnosticar TVP distales, por ello, en pacientes con alta o intermedia probabilidad clínica y DD positivo se recomienda repetir la exploración a los 5 o 7 días para descartar una progresión proximal, si una TVP distal pasó desapercibida12,13 y no existe un diagnóstico alternativo más probable. Esta progresión proximal de la trombosis ha sido reportada en alrededor de un 9% de los casos23. Una exploración completa de la extremidad requiere más tiempo y de personal más experimentado. Estudios previos han demostrado que el riesgo de episodios tromboembólicos venosos a los 3 meses de seguimiento sin anticoagulación es muy bajo (0,57%) tras una primera exploración negativa24 y que ambas modalidades son equivalentes en pacientes no hospitalizados con sospecha de TVP en las extremidades inferiores25. Si se opta por esta segunda modalidad y es normal, no serían necesarias exploraciones seriadas12,13. Sin embargo, si se diagnostica una TVP distal aislada, muchas veces su significado clínico es incierto y puede conducir a un tratamiento innecesario. De todas formas, un reciente metaanálisis demostró que la anticoagulación de la TVP distal aislada reducía el riesgo de recurrencias tromboembólicas venosas y la incidencia de embolia pulmonar, sin un incremento significativo del riesgo de sangrado grave26. En el último documento de consenso de la Sociedad Americana de Radiólogos, en ecografía27 se recomienda la realización de una primera ecografía completa con doppler-color de la toda la extremidad. Para evitar tratamientos innecesarios tras el diagnóstico de una TVP distal aislada, recomiendan repetir la exploración a los 7 días y solo tratar si se observa progresión proximal de la trombosis. Si no se observan cambios, recomiendan su repetición a las 2semanas. Si se ha resuelto o no hay progresión, no son necesarias nuevas exploraciones. En este sentido The American College of Chest Physicians en su última revisión de 2016 recomienda controles ecográficos seriados durante 2semanas solo si los síntomas no son graves o no hay factores de riesgo de extensión proximal; en caso contrario, recomienda iniciar anticoagulación de forma similar a la TVP proximal28.
A) Vena femoral normal sin compresión. B) Vena femoral normal con compresión, que la colapsa completamente. C) Imagen de trombosis venosa con material ecogénico en el interior de la vena. D) Falta de compresibilidad. Fuente: Imagen obtenida de Neddleman et al.27.
Se consideran factores de riesgo de extensión proximal: la positividad del DD, una trombosis extensa o cercana a las venas proximales, ausencia de factores de riesgo reversibles para TVP, cáncer activo, historia de ETV u hospitalización. Cuando se opta por una ecografía proximal, un protocolo al alcance de los servicios de urgencias es la compresión ecográfica en 2 puntos(vena femoral común y vena poplítea) o 3 (añadiendo vena femoral superficial).
Un reciente metaanálisis29 que incluyó 17 estudios prospectivos en los que el comparador fue la ecografía realizada por radiólogos, se observó una elevada sensibilidad y especificidad (> 90%) para el diagnóstico de TVP con un bajo porcentaje de falsos negativos (4%) y sin diferencias entre ambos protocolos. Esta estrategia puede resultar especialmente útil en aquellos centros en los que no se dispone de radiólogos las 24 h del día, aunque requiere de una curva de aprendizaje para un amplio número de médicos ubicados en los servicios de urgencias. Sería recomendable que cada centro diseñase el protocolo más adecuado en función de sus posibilidades. Otras técnicas útiles para el diagnóstico de la TVP son la venografía por RM y la TAC en fase venosa. La venografía por RM permite diagnosticar la TVP sin necesidad de administrar contraste utilizando diferentes secuencias, aunque su administración la convierte en una técnica más reproducible y menos susceptible a los artefactos. Tiene una elevada sensibilidad y especificidad para el diagnóstico de TVP proximal, aunque similar a la ecografía30. Ofrece alguna ventaja adicional, como la evaluación de las venas pélvicas, así como el descarte de compresiones extrínsecas y de enfermedad subyacente. La TAC en fase venosa requiere de la administración de contraste. Se ha utilizado generalmente para el diagnóstico de la TVP junto con la angio-TAC pulmonar ante la sospecha de embolia pulmonar. En este contexto, en una metaanálisis se observó una alta sensibilidad (95,9%) y especificidad (95,2%), aunque también similar a la ecografía31. De todas formas, ambas técnicas no deben sustituir de forma rutinaria a la ecografía en el diagnóstico de la TVP (fig. 2).
Algoritmo para el diagnóstico de TVP en las extremidades inferiores.
*Si se realiza una ecografía completa de toda la extremidad por personal experimentado, no sería necesarias exploraciones seriadas
**Técnica de DD de alta sensibilidad.
***Siempre que no haya un diagnóstico alternativo más probable.
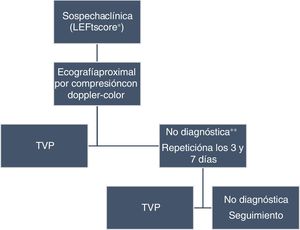
El embarazo y el puerperio son factores de riesgo bien establecidos para el desarrollo de ETV y esta supone una de las principales causas de mortalidad en países desarrollados. El diagnóstico de TVP no siempre es sencillo porque a lo largo del embarazo pueden aparecer síntomas que la simulan, especialmente edema en las extremidades por estasis debido a un incremento progresivo de la presión intraabdominal. Otra característica diferencial es la afectación predominante de la extremidad inferior izquierda y, con frecuencia, la presentación de trombosis aislada de la vena ilíaca. Los modelos de probabilidad clínica, como la escala de Wells, no han sido validados en esta población. Además, incluyen ítems muy poco frecuentes en mujeres sanas embarazadas, como cáncer, inmovilización o cirugía reciente. Por ello, no suele recomendarse su uso12. Otro modelo de probabilidad clínica, más reciente y diseñado para esta población es LEFt score. Este modelo incluye 3 variables: síntomas en la pierna izquierda (L-left), incremento de> 2cm del diámetro de la pantorrilla (E-edema) y presentación en el primer trimestre de embarazo (Ft-firsttrimester).
La prevalencia de TVP fue del 0, 4,8, 29,2 y 50% en mujeres con sospecha de trombosis que puntuaban 0, 1, 2 y 3, respectivamente, en un estudio de validación externa, aunque se trataba de un análisis post hoc de un estudio prospectivo, lo que suponía una limitación32. Hasta el momento no existen estudios prospectivos de validación de dicha escala y no se aconseja su uso rutinario para la exclusión de la TVP en mujeres embarazadas.
El valor del DD se incrementa de forma fisiológica a lo largo del embarazo16, por lo que su utilización tiene un valor muy limitado en la exclusión de la TVP debido al elevado número de falsos positivos.
La técnica de imagen más adecuada para su diagnóstico es la ecografía venosa por compresión. Se recomienda de inicio una ecografía proximal y suplementarla con el sistema doppler-color para visualizar la vena ilíaca. Si la primera exploración es negativa y la sospecha clínica es elevada, se recomienda su repetición a los 3 y 7 días. Se ha demostrado que esta estrategia es segura y que la incidencia de ETV en los siguientes 3meses es muy baja (< 1%)33. Otra opción sería una única ecografía doppler completa de toda la extremidad, sin necesidad de exploraciones seriadas. Esta segunda estrategia también parece segura, ya que ha demostrado una baja incidencia de ETV en el seguimiento (1,1%) en caso de negatividad de la prueba34. Aunque no hay datos comparativos entre ambas estrategias, las diferentes guías parecen optar por la primera12,35-37. En las ocasiones en las que se sospeche una TVP ilíaca aislada y la ecografía con doppler sea negativa o no concluyente, puede recurrirse a la venografía por RM para confirmar o excluir el diagnóstico38 (fig. 3).
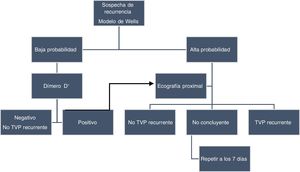
Recurrencia de la trombosis venosa profundaEl diagnóstico de una TVP recurrente de la misma extremidad puede resultar complejo por diferentes motivos. Tras un primer episodio, es frecuente la persistencia de sintomatología compatible con un síndrome postrombótico, que puede dificultar la interpretación de nuevos síntomas. En segundo lugar, el DD puede persistir elevado y ser de menor utilidad para excluir un nuevo diagnóstico. En tercer lugar, es frecuente la trombosis residual y ello dificulta la interpretación de los resultados ecográficos. Los modelos de probabilidad clínica no han sido validados específicamente en pacientes con sospecha de TVP recurrente. Además el modelo de Wells incluye como ítem el haber padecido un episodio previo, lo que hace que un mayor porcentaje de pacientes tenga una probabilidad intermedia o alta de TVP. Por esta razón, The American College of Chest Physicians12 en 2012 no recomendaba su uso. En cambio, a pesar de las posibles limitaciones, la Sociedad Internacional de Trombosis y Hemostasia en el documento de consenso de 201339 y la Sociedad Americana de Hematología en las recomendaciones publicadas en 201813 proponen su utilización. Aunque recomiendan clasificar a los pacientes solo en 2categorías: probable o improbable. Tras un primer episodio trombótico, el DD puede permanecer elevado en> 30% de los pacientes un mes después de finalizar el tratamiento anticoagulante40 y, aproximadamente, solo la mitad de los pacientes persisten con el DD negativo a lo largo del tiempo41. De todas formas, ante la sospecha de TVP recurrente, el DD mantiene un elevado valor predictivo negativo y resulta útil para excluir su diagnóstico en pacientes con baja probabilidad clínica, de forma similar a un primer episodio, aunque con esta estrategia el número de pacientes que podemos excluir es inferior42. En este contexto se recomienda utilizar para su determinación una técnica de alta sensibilidad12,39. La trombosis venosa residual tras un primer episodio es frecuente, por lo que se recomienda una ecografía por compresión al finalizar el tratamiento anticoagulante para comparar los hallazgos en caso de posible recurrencia27. Los criterios ecográficos que permiten diagnosticar una recurrencia trombótica son la falta de compresibilidad de un segmento venoso previamente no afectado o un incremento> 4mm en el diámetro venoso durante la compresión en un segmento con trombosis residual12,13,27,39. En aquellos pacientes con resultados ecográficos no concluyentes, se debería repetir la exploración a los 7 días, sobre todo si el DD es positivo o la sospecha clínica sigue siendo elevada. En los últimos años se ha introducido una técnica para estudiar de manera directa el trombo por RM (magnetic resonance direct thrombus imaging) que permite identificar un coágulo en fase aguda, utilizando diferentes secuencias sin necesidad de administrar contraste. Ello resulta útil en el diagnóstico de una retrombosis en la misma extremidad. En un reciente estudio, Van Dam et al.43 observaron que, en pacientes con sospecha de recurrencia trombótica, durante los 3 meses siguientes a una RM negativa la incidencia de ETV fue tan solo del 1,1%. De todas formas, la ecografía sigue siendo la exploración inicial en el diagnóstico de recurrencia de la TVP (fig. 4).
Trombosis venosa profunda en las extremidades superioresLa TVP en las extremidades superiores supone hasta el 10% del total, con una incidencia anual estimada de 3 por 100.000 personas. Puede ser primaria, generalmente relacionada con esfuerzos repetidos en pacientes jóvenes (síndrome de Paget-Schroetter), o secundaria. Los principales factores de riesgo son la inserción de un catéter o el cáncer44. El diagnóstico puede plantear dificultades por varios motivos. La anatomía venosa de la extremidad superior es diferente de la de la extremidad inferior y las estrategias diagnósticas no pueden extrapolarse. Hay segmentos venosos que no pueden ser sometidos a compresión ecográfica, como el segmento más proximal de la vena subclavia o venas de localización intratorácica, como la vena innominada o la cava superior. Existe menos evidencia publicada sobre las estrategias más adecuadas para su diagnóstico.
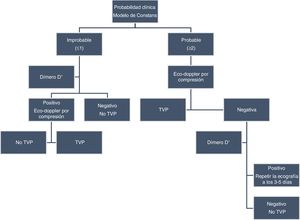
El único modelo de probabilidad clínica publicado es el modelo de Constans, que utiliza 4ítems (tabla 3): inserción de catéter o marcapasos (+1), dolor localizado (+1), edema de la extremidad (+1) y un diagnóstico alternativo más plausible (−1). Los pacientes fueron categorizados en riesgo bajo (≤0), intermedio (1) y alto (≥2) con una prevalencia del TVP de 13, 38 y 69%, respectivamente45. Aunque hay pocos estudios respecto a la utilización del DD en las estrategias diagnósticas de la TVP en las extremidades superiores, se ha observado que, con un punto de corte> 500 ng/ml, tiene un elevado valor predictivo negativo para su exclusión46, de forma similar a la TVP en las extremidades inferiores.
Modelo clínico de Constans para el diagnóstico de TVP en las extremidades superiores
| Características clínicas | Valor |
|---|---|
| Catéter venoso central o marcapasos | 1 |
| Dolor localizado en la extremidad | 1 |
| Edema unilateral | 1 |
| Diagnóstico alternativo al menos tan probable como la trombosis venosa profunda | −1 |
≤0: probabilidad baja; 1: probabilidad intermedia; ≥2: probabilidad alta.
≥2: probable; ≤1: improbable.
La flebografía convencional sigue siendo la técnica de referencia para el diagnóstico de la TVP en las extremidades superiores y podría ser necesaria cuando la ecografía aporta información no concluyente. De todas formas, en la actualidad se considera que la primera exploración es la ecografía por compresión, que ha demostrado una sensibilidad y especificidad> 90%. La adición del sistema doppler-color, aunque no mejora su sensibilidad, es útil para la evaluación de los segmentos venosos no compresibles47. Otras técnicas, como la RM o la TAC en fase venosa podrían utilizarse para la evaluación de las venas intratorácicas48. Hay pocos estudios que hayan evaluado estrategias que incluyan el modelo de probabilidad clínica, el DD y la ecografía por compresión para el diagnóstico de TVP en las extremidades superiores. Kleinjan et al.49 utilizaron el modelo de Constans y dividieron a los pacientes en 2categorías: probable (≥ 2) o improbable (≤ 1). En aquellos pacientes con baja probabilidad clínica y DD negativo se excluyó el diagnóstico sin realizar ecografía. Al resto se les realizaba una ecografía por compresión. Los pacientes sin TVP fueron seguidos durante 3 meses y solo uno desarrolló la trombosis (0,4%).
Más tarde, Van Es et al.50 utilizaron un protocolo similar y excluyeron la TVP en un 21% de los pacientes sin necesidad de ecografía. Ninguno desarrolló trombosis en el seguimiento. Aunque observaron que esta estrategia era menos eficiente en pacientes hospitalizados, con catéter venoso central y cáncer. Los mismos autores más tarde aplicaron el mismo protocolo, pero utilizando un DD ajustado a la edad: solo se consiguió incrementar un 3,7% el número de pacientes en los que no eran necesarias las técnicas de imagen51 (fig. 5).
Nota al suplementoEste artículo forma parte del suplemento «Protocolos de manejo de la enfermedad tromboembólica venosa. Actualización 2020», que cuenta con la colaboración de Laboratorios Rovi para la impresión y difusión del suplemento.