1615 - ESTUDIO COMPARATIVO EN VIDA REAL DEL USO DE SEMAGLUTIDA EN FORMULACIÓN SUBCUTÁNEA U ORAL INICIADA DE NOVO EN PACIENTES CON DIABETES TIPO 2: ¿SE TOLERAN IGUAL?
1Hospital Universitario de Móstoles, Madrid, España. 2Universidad Francisco de Vitoria, Majadahonda, España.
Objetivos: Los agonistas del receptor del péptido similar al glucagón tipo 1 (aGLP-1) reducen de manera potente la HbA1c, presentan bajo riesgo de hipoglucemia, reducen el peso y se han demostrado beneficios renales y cardiovasculares, con efectos adversos menores1. En el estudio PIONEER 8 (semaglutida oral, SEMAo), los efectos adversos más frecuentes fueron gastrointestinales: nauseas (11-23%), vómitos (6-9,9%) y diarrea (8,7%-14,9%), y su frecuencia fue dosis dependiente (2). De forma similar ocurrió en el SUSTAIN 5 (semaglutida subcutánea, SEMAsc), con las dosis de 0,5 y 1 mg semanal: nauseas (11,4-16,8%), vómitos (6,1-11,5%) y diarrea (4,5-6,9%) (3). Siendo la frecuencia global de intolerancias digestivas parecidas. En este contexto, planteamos evaluar en vida la real si la frecuencia reportada de efectos adversos por intolerancia digestiva sería similar en los pacientes tratados con SEMAo como con SEMAsc.
Métodos: Estudio observacional retrospectivo, con inclusión consecutiva de pacientes que acuden a Consultas de nuestro centro entre noviembre 2022 y enero 2023, con inicio en el momento de la visita o habiendo iniciado previamente SEMAo/SEMAsc de novo (sin otros aGLP-1 previos).
Resultados: Las características basales previas al inicio de semaglutida fueros similares (tabla 1). Si bien, destaca un mayor tiempo de evolución de DM2 en los pacientes con SEMAsc (12,7 ± 11,1 años vs. 4,6 ± 3,8, p = 0,006). Las dosis máximas alcanzadas fueron similares, tal y cómo se muestras en la tabla 2. Cabe resaltar, que la mediana hasta alcanzar dosis máxima fue de 8,7 semanas con SEMAo y en el grupo de SEMAsc esta fue mayor, con una mediana de 20,7 semanas. Se evidencia así, que aparentemente en práctica clínica real la escalada de dosis en su mayoría no atiende a las recomendaciones de incremento semanal hasta dosis máximas. Respecto a los efectos adversos reportados, la intolerancia digestiva fue la más frecuente de forma global (9,5%, n = 4). Estos efectos digestivos se dieron en un 25% en el grupo de SEMAo (n = 3) y únicamente en un 3,3% en el grupo de SEMAsc (n = 1). Destaca que la diferencia entre ambos grupos es estadísticamente significativa, p = 0,018.

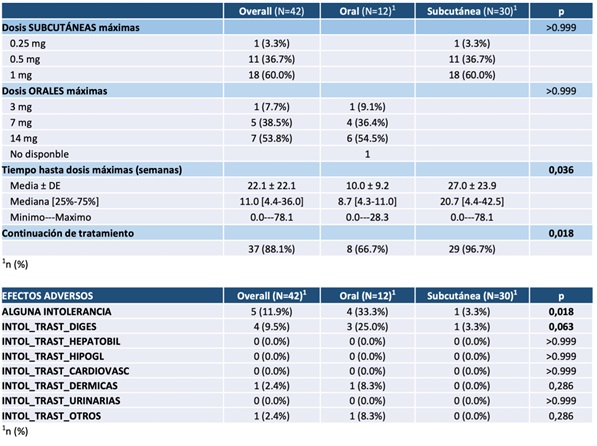
Discusión: Llama la atención menores intolerancias digestivas en el grupo de SEMAsc respecto a SEMAo. Entre las posibles causas, planteamos la posibilidad de que fuera debido a un mayor tiempo en los pacientes con SEMAsc hasta alcanzar dosis máximas, lo cual haya podido favorecer la tolerancia de SEMAsc con el incremento más paulatino de dosis. O bien, visto desde otro punto, que el incremento de dosis más rápido con SEMAo, sea la causa de mayores intolerancias digestivas en este grupo. Si bien, esta hipótesis no se ha podido demostrar en nuestro estudio.
Conclusiones: En nuestra cohorte, los pacientes tratados con SEMAo presentaron una mayor frecuencia de efectos adversos gastrointestinales al compararlos con los pacientes tratados con SEMAsc, siendo las diferencias estadísticamente significativas. Esto lleva a plantear la hipótesis de que es debido a una escala más paulatina de dosis en el grupo de SEMAsc o bien que un incremento de dosis más rápido en el grupo de SEMAo. Si bien, serían necesarias nuevos estudios dirigidos para analizar dicha hipótesis.
Bibliografía
- Cases A. Agonistas del receptor de péptido similar al glucagón tipo 1 (GLP-1) en el manejo del paciente con diabetes mellitus tipo 2. Una aproximación para el nefrólogo. Nefrología. 2022.
- Zinman B, Aroda VR, Buse JB, et al. Efficacy, Safety, and Tolerability of Oral Semaglutide Versus Placebo Added to Insulin With or Without Metformin in Patients With Type 2 Diabetes: The PIONEER 8 Trial. Diabetes Care. 2019 Dec 1;42(12):2262-71.
- Rodbard HW, Lingvay I, Reed J, et al. Semaglutide Added to Basal Insulin in Type 2 Diabetes (SUSTAIN 5): A Randomized, Controlled Trial. J Clin Endocrinol Metab. 2018 Jun 1;103(6):2291-301.






