En España, los estudios epidemiológicos de prevalencia de enfermedad pulmonar intersticial difusa (EPID) en artritis reumatoide (AR) son escasos y limitados. Nuestro objetivo fue estimar la prevalencia de EPID sintomática en AR y sus características en nuestra área.
Materiales y métodosSe diseñó un estudio observacional longitudinal prospectivo en la consulta interdisciplinar de Reumatología y Neumología, en el que incluimos AR con síntomas respiratorios y EPID confirmada por tomografía computarizada de alta resolución.
ResultadosDe las 2.729 personas con AR de nuestra área, 47 presentaban EPID sintomática, estimándose una prevalencia de EPID sintomática en AR del 1,72% (intervalo de confianza del 95%: 1,26-2,29) con una edad al diagnóstico de AR de 57,3±13,3 años. Fue más frecuente en hombres, el 60,6% tenía antecedente de tabaquismo y el 84,3 y el 84,7% factor reumatoide y anticuerpos antipéptidos cíclicos citrulinados, respectivamente. El patrón más frecuente fue neumonía intersticial usual (NIU) en 28 (31,1%), la neumonía intersticial no específica (NINE) fue más frecuente en mujeres y el síndrome combinado enfisema-fibrosis (SCEF) exclusivamente en hombres.
ConclusionesEn este estudio hemos analizado la prevalencia de AR-EPID sintomática en nuestra área, la cual está por debajo de lo esperado, probablemente en relación con las definiciones utilizadas. Así mismo, hemos descrito que el patrón NIU es el más frecuente en la AR, seguido del NINE y analizado por primera vez la prevalencia de SCEF en la AR, que alcanza el 13%.
In Spain, epidemiological studies of the prevalence of diffuse interstitial lung disease (ILD) in rheumatoid arthritis (RA) are limited. Our objective was to estimate the prevalence of symptomatic ILD in RA and its characteristics in our area.
Materials and methodsIn our hospital's interdisciplinary rheumatology and pulmonology clinic, a prospective longitudinal observational study was designed in which we included RA with respiratory symptoms and ILD confirmed by high resolution computed tomography.
ResultsOf the 2,729 people with RA in our area, 47 had symptomatic ILD, estimating a prevalence of symptomatic ILD in RA of 1.72% (95% CI 1.26 - 2.29) with an age at diagnosis of RA of 57.3±13.3 years. It was more frequent in men, 60.6% had a history of smoking, and 84.3% and 84.7% had rheumatoid factor (RF) and anti-cyclic citrullinated peptide (Anti-CCP) antibodies, respectively. The most frequent pattern was usual interstitial pneumonitis (UIP), appearing in 28 (31.1%). Nonspecific interstitial pneumonia (NSIP) was more frequent in women, while the combined pulmonary fibrosis-emphysema (CPFE) syndrome presented exclusively in men.
ConclusionsWe have analysed the prevalence of symptomatic RA-ILD in our area, which is lower than expected, probably in relation to the definitions used. We have also described that the UIP pattern is the most frequent in RA in our environment, followed by the NSIP. Lastly, we have analysed the prevalence of CPFE in RA, which reaches 13%, for the first time.
La artritis reumatoide (AR) es una enfermedad inflamatoria sistémica, caracterizada por la inflamación crónica de las articulaciones, con su consecuente destrucción, deformidad e incapacidad1, con manifestaciones extraarticulares que contribuyen a la morbimortalidad2. El pulmón es lugar habitual de afectación extraarticular, cuya manifestación más frecuente es la enfermedad pulmonar intersticial difusa (EPID)3. Hasta un 58% de los pacientes con AR pueden tener afectación pulmonar, que se asocia con la mortalidad en un 10-20% de casos4.
Es de gran interés conocer la prevalencia de la AR con EPID (AR-EPID) clínica, sus factores de riesgo y su forma de presentación. En España, los estudios epidemiológicos de prevalencia de AR-EPID son escasos y limitados5, y los estudios descriptivos de la afectación pulmonar incluyen pocos pacientes con AR6,7.
En 2007 se inició en el Hospital Universitario La Paz (HULP) de Madrid una consulta pionera, interdisciplinar, entre los servicios de Reumatología y Neumología, para la valoración conjunta de afectación pulmonar en enfermedades sistémicas inmunomediadas, integrada en la unidad de EPID del centro, acreditada por la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) como unidad interdisciplinar de alta complejidad. Esto permite una recogida de datos estructurada que consigue estudiar la dimensión total de esta enfermedad en nuestra zona.
El objetivo de este estudio es estimar la prevalencia de EPID sintomática, sus patrones radiológicos en la AR y las características de los pacientes que desarrollan síntomas respiratorios, en el área sanitaria de un hospital de tercer nivel.
Pacientes y métodosSe diseñó un estudio observacional longitudinal prospectivo entre el 2007 y el 2018 en la consulta interdisciplinar de Reumatología y Neumología del HULP. El protocolo fue aprobado por el comité ético de investigación del HULP.
PoblaciónSe incluyó a los pacientes del área y los estudiados en el servicio de Reumatología que cumplían los criterios de AR de 1987 o de 20108,9 y que hubieran sido remitidos a la consulta interdisciplinar de Reumatología y Neumología con sospecha de EPID por síntomas (tos, disnea), signos (auscultación patológica) o alteración en prueba de imagen.
Definición de caso y recogida de datosSe definió EPID sintomática si presentaba tos, disnea o crepitantes en la auscultación pulmonar en un paciente con una tomografía computarizada de alta resolución (TCAR) diagnóstica de EPID. Se excluyó a pacientes con síndrome de superposición o con otras causas posibles de EPID.
Se recogieron variables sociodemográficas y clínicas, tabaquismo, tratamientos recibidos por la AR, síntomas respiratorios (tos y disnea), presencia de crepitantes, título de factor reumatoide (FR) y anticuerpos antipéptidos cíclicos citrulinados (ACPA), pruebas de función respiratoria (PFR) y patrones radiológicos por TCAR.
Para las PFR se empleó un equipo MasterLab-body 6.0 (Viasys, Wuerzburg, Alemania), siguiendo las recomendaciones de la ATS/ERS para la calibración y procedimientos de medida10. El procedimiento para la espirometría lenta y forzada es el descrito por SEPAR11. Como valores de referencia se utilizaron los propuestos por la Global Lung Initiative12. La capacidad de difusión de monóxido de carbono (DLCO) se midió con el mismo equipo con la técnica de respiración única y se corrigió en función de la hemoglobina, con los valores de referencia propuestos por Cotes13. La función pulmonar se consideró anormal si la CVF o la DLCO eran menores del 80%14.
El diagnóstico de EPID fue mediante TCAR; el protocolo incluyó un topograma para determinar los límites del volumen que se debía adquirir en inspiración máxima, en sentido cráneo caudal. También se obtuvieron cortes en espiración a nivel de cayado y a la entrada de las venas pulmonares, para valorar el atrapamiento aéreo. Se utilizó un equipo de TC 16 detectores SOMATON EMOTION 16 (Siemens Medical Solutions, Erlangen, Alemania).
Los parámetros de irradiación se ajustaron de forma convencional con respecto a las características morfológicas de cada paciente: 120 kV, con corriente del tubo de 160mA. El grosor de corte empleado fue 0,75mm, con un incremento de reconstrucción de 0,5mm, una relación de paso en el barrido espiral (pitch) de 0,8mm y un grosor de colimación de 0,6mm. Se utilizaron 2algoritmos de reconstrucción estándar (filtro B 41 para valoración de partes blandas y filtro B 90 de alta resolución para mejor evaluación del parénquima pulmonar).
Las imágenes fueron interpretadas por 2radiólogos de la sección de tórax de nuestro hospital, expertos en enfermedad intersticial, del equipo multidisciplinar de EPID.
Análisis estadísticoSe analizaron los datos sociodemográficos y clínicos, las PFR y los patrones radiológicos. La descripción de la muestra se llevó a cabo mediante medidas de tendencia central y de dispersión para variables cuantitativas, así como tablas de frecuencias y distribución de porcentajes para las cualitativas.
Tras la descripción de la muestra de análisis, se estimó la prevalencia poblacional de EPID sintomática en AR en los casos pertenecientes al área de referencia del HULP.
Para el estudio de prevalencia de EPID se manejó como denominador todas las AR aportadas por los centros de salud del área vivos en octubre del 2018 y como numerador, aquellos que presentaban EPID sintomática. Para calcular las prevalencias, y su intervalo de confianza (IC) del 95%, se asumió una distribución de Poisson. Los resultados se expresaron de forma global y por estratos de edad y sexo.
En los pacientes con EPID se estableció la frecuencia de los distintos patrones de afectación radiológica clasificados como: neumonía intersticial usual (NIU); probable NIU; síndrome combinado enfisema-fibrosis (SCEF); neumonía intersticial no específica (NINE); neumonía organizada (NO); neumonía intersticial linfoide (NIL) y otros. Para ello se utilizó la clasificación de neumonías intersticiales idiopáticas de la European Respiratory Society (ERS) y la American Respiratory Society del 2013, y las recomendaciones de fibrosis pulmonar idiopática realizadas conjuntamente por la American Thoracic Society, la European Respiratory Society, la Japanese Respiratory Society y la Latin American Thoracic Society15,16.
Se crearon y compararon los siguientes grupos de patrones: (NIU + probable NIU) vs. (NINE).
Comparamos las características sociodemográficas y clínicas, y las PFR basal entre ambos grupos mediante pruebas de contraste de hipótesis para variables continuas (t de Student o U de Mann-Whitney, según su distribución) y categóricas (chi al cuadrado).
ResultadosSe registraron 2.729 casos de AR en el área, que supone una prevalencia de AR del 0,62%, dentro de lo esperado. El registro de AR-EPID sintomática incluía a 92 pacientes, se eliminaron 2(una artritis idiopática juvenil y una neumoconiosis). De los 90 incluidos, 69 pertenecían al área del HULP y 47 seguían vivos en la fecha del estudio.
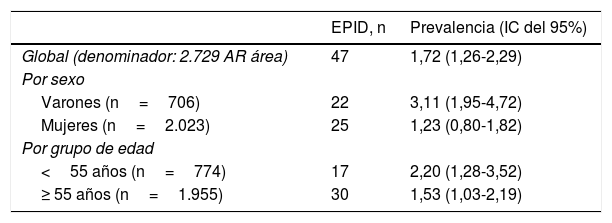
La prevalencia poblacional de AR-EPID sintomática del área del HULP se estimó en un 1,72% (IC del 95%: 1,26-2,29). Por sexos, fue mayor en varones (3,11% vs. 1,23%), por grupos de edad, el valor más elevado se obtuvo en los menores de 55 años respecto a los mayores de esta edad (2,20, IC del 95%: 1,28-3,52 vs. 1,53, IC del 95%: 1,03-2,19). Si bien, para el sexo los IC no solapan, lo cual indica que la diferencia es estadísticamente significativa, esto no ocurre con la edad y la diferencia observada puede deberse al azar (tabla 1).
Prevalencia de enfermedad pulmonar intersticial difusa en artritis reumatoide, área del Hospital Universitario La Paz (Madrid)
| EPID, n | Prevalencia (IC del 95%) | |
|---|---|---|
| Global (denominador: 2.729 AR área) | 47 | 1,72 (1,26-2,29) |
| Por sexo | ||
| Varones (n=706) | 22 | 3,11 (1,95-4,72) |
| Mujeres (n=2.023) | 25 | 1,23 (0,80-1,82) |
| Por grupo de edad | ||
| <55 años (n=774) | 17 | 2,20 (1,28-3,52) |
| ≥ 55 años (n=1.955) | 30 | 1,53 (1,03-2,19) |
AR: artritis reumatoide; IC: intervalo de confianza; EPID: enfermedad pulmonar intersticial difusa.
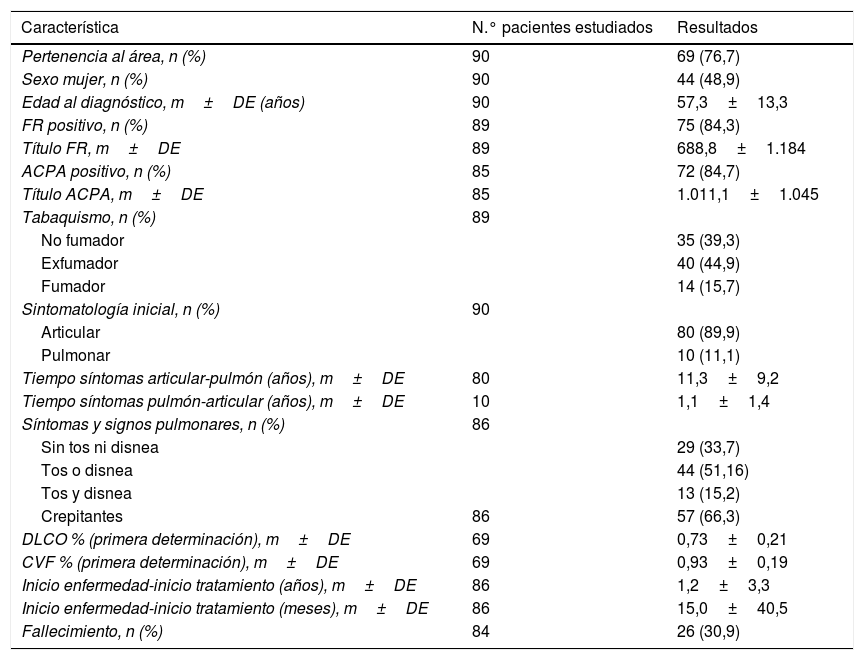
La tabla 2 muestra la descripción de los 90 pacientes con AR y EPID de nuestra serie. La edad media al diagnóstico de la AR fue 57,3±13,3 años y 49 (48,9%) eran mujeres. La mayoría, FR y ACPA positivos, el 16% fumadores y un 45% exfumadores. La afectación articular fue la sintomatología de inicio en 80 casos (90%), con una mediana de tiempo transcurrido entre el inicio de los síntomas articulares y respiratorios de 9,9 años. En la visita basal el 23% presentaba tos; el 58%, disnea; el 15,2%, tos y disnea, y el 66%, crepitantes.
Descripción de la muestra de pacientes con artritis reumatoide y enfermedad pulmonar intersticial difusa, área del Hospital Universitario La Paz (Madrid)
| Característica | N.° pacientes estudiados | Resultados |
|---|---|---|
| Pertenencia al área, n (%) | 90 | 69 (76,7) |
| Sexo mujer, n (%) | 90 | 44 (48,9) |
| Edad al diagnóstico, m±DE (años) | 90 | 57,3±13,3 |
| FR positivo, n (%) | 89 | 75 (84,3) |
| Título FR, m±DE | 89 | 688,8±1.184 |
| ACPA positivo, n (%) | 85 | 72 (84,7) |
| Título ACPA, m±DE | 85 | 1.011,1±1.045 |
| Tabaquismo, n (%) | 89 | |
| No fumador | 35 (39,3) | |
| Exfumador | 40 (44,9) | |
| Fumador | 14 (15,7) | |
| Sintomatología inicial, n (%) | 90 | |
| Articular | 80 (89,9) | |
| Pulmonar | 10 (11,1) | |
| Tiempo síntomas articular-pulmón (años), m±DE | 80 | 11,3±9,2 |
| Tiempo síntomas pulmón-articular (años), m±DE | 10 | 1,1±1,4 |
| Síntomas y signos pulmonares, n (%) | 86 | |
| Sin tos ni disnea | 29 (33,7) | |
| Tos o disnea | 44 (51,16) | |
| Tos y disnea | 13 (15,2) | |
| Crepitantes | 86 | 57 (66,3) |
| DLCO % (primera determinación), m±DE | 69 | 0,73±0,21 |
| CVF % (primera determinación), m±DE | 69 | 0,93±0,19 |
| Inicio enfermedad-inicio tratamiento (años), m±DE | 86 | 1,2±3,3 |
| Inicio enfermedad-inicio tratamiento (meses), m±DE | 86 | 15,0±40,5 |
| Fallecimiento, n (%) | 84 | 26 (30,9) |
ACPA: anticuerpos antipéptidos cíclicos citrulinados; CVF: capacidad vital forzada; DE: desviación estándar; DLCO: capacidad de difusión de monóxido de carbono; FR: factor reumatoide.
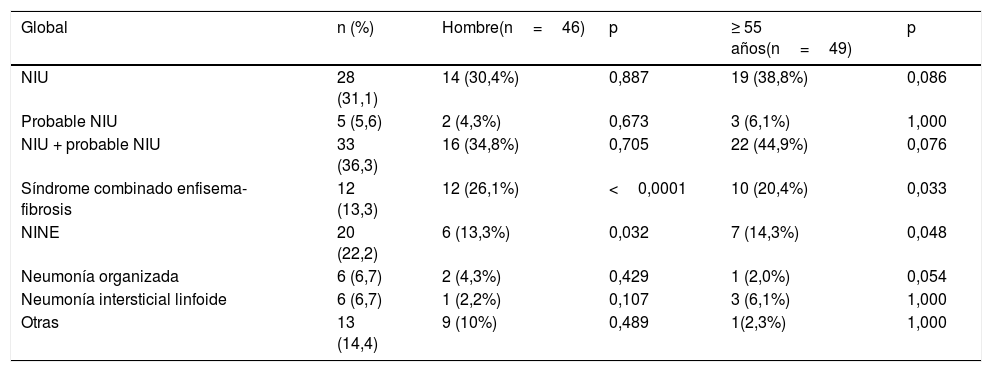
El patrón radiológico más frecuente fue NIU (31%), seguido de NINE (22%), el SCEF (13%), el patrón inespecífico (10%) y la NO y NIL (6,7%) (tabla 3). En cuanto la distribución por sexo, la NINE fue más frecuente en mujeres (34% vs. 13%; p=0,032) y el SCEF solo apareció en varones (26%; p <0,0001). Respecto a la edad, se observó mayor frecuencia de NINE en los <55 años (32% vs. 14%; p=0,048) y el SCEF en el grupo de mayor edad (20% vs. 5%; p=0,03). La NIU también fue más frecuente en mayores de 55 años (39% vs. 22%; p <0,08) pero no alcanzó significación estadística (SE) (tabla 3).
Descripción y distribución de patrones radiológicos de enfermedad pulmonar intersticial difusa en artritis reumatoide (n=90) global, por sexo y grupo de edad
| Global | n (%) | Hombre(n=46) | p | ≥ 55 años(n=49) | p |
|---|---|---|---|---|---|
| NIU | 28 (31,1) | 14 (30,4%) | 0,887 | 19 (38,8%) | 0,086 |
| Probable NIU | 5 (5,6) | 2 (4,3%) | 0,673 | 3 (6,1%) | 1,000 |
| NIU + probable NIU | 33 (36,3) | 16 (34,8%) | 0,705 | 22 (44,9%) | 0,076 |
| Síndrome combinado enfisema-fibrosis | 12 (13,3) | 12 (26,1%) | <0,0001 | 10 (20,4%) | 0,033 |
| NINE | 20 (22,2) | 6 (13,3%) | 0,032 | 7 (14,3%) | 0,048 |
| Neumonía organizada | 6 (6,7) | 2 (4,3%) | 0,429 | 1 (2,0%) | 0,054 |
| Neumonía intersticial linfoide | 6 (6,7) | 1 (2,2%) | 0,107 | 3 (6,1%) | 1,000 |
| Otras | 13 (14,4) | 9 (10%) | 0,489 | 1(2,3%) | 1,000 |
NINE: neumonía intersticial no específica; NIU: neumonía intersticial usual.
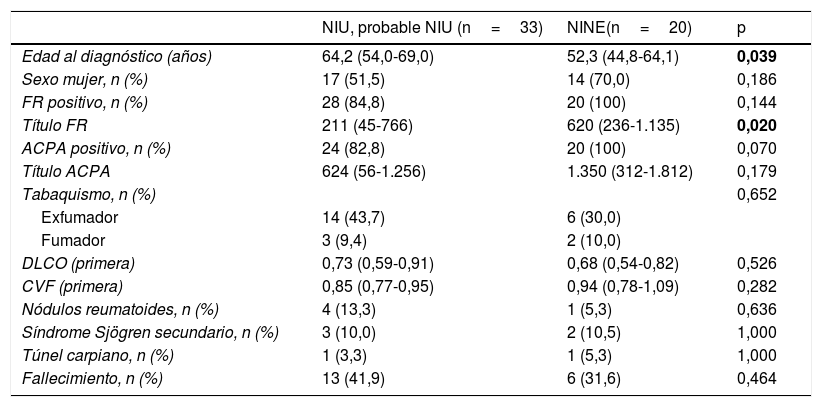
Al comparar por grupos radiológicos, NIU + probable NIU frente NINE (tabla 4), la edad media al diagnóstico en el grupo con NIU + probable NIU era 64,2 frente a 52,3 (p=0,039) y la NINE fue más frecuente en mujeres (70 vs. 51,5%; p=0,186) pero no alcanzó SE (p=0,18). Al comparar el patrón NINE con NIU + probable NIU se observó que el título de FR era mayor en pacientes con NINE (p=0,020). Respecto a la DLCO y la CVF, no encontramos diferencias significativas, probablemente por el tamaño de la muestra (tabla 4).
Comparación patrones radiológicos
| NIU, probable NIU (n=33) | NINE(n=20) | p | |
|---|---|---|---|
| Edad al diagnóstico (años) | 64,2 (54,0-69,0) | 52,3 (44,8-64,1) | 0,039 |
| Sexo mujer, n (%) | 17 (51,5) | 14 (70,0) | 0,186 |
| FR positivo, n (%) | 28 (84,8) | 20 (100) | 0,144 |
| Título FR | 211 (45-766) | 620 (236-1.135) | 0,020 |
| ACPA positivo, n (%) | 24 (82,8) | 20 (100) | 0,070 |
| Título ACPA | 624 (56-1.256) | 1.350 (312-1.812) | 0,179 |
| Tabaquismo, n (%) | 0,652 | ||
| Exfumador | 14 (43,7) | 6 (30,0) | |
| Fumador | 3 (9,4) | 2 (10,0) | |
| DLCO (primera) | 0,73 (0,59-0,91) | 0,68 (0,54-0,82) | 0,526 |
| CVF (primera) | 0,85 (0,77-0,95) | 0,94 (0,78-1,09) | 0,282 |
| Nódulos reumatoides, n (%) | 4 (13,3) | 1 (5,3) | 0,636 |
| Síndrome Sjögren secundario, n (%) | 3 (10,0) | 2 (10,5) | 1,000 |
| Túnel carpiano, n (%) | 1 (3,3) | 1 (5,3) | 1,000 |
| Fallecimiento, n (%) | 13 (41,9) | 6 (31,6) | 0,464 |
Variables continuas expresadas como mediana (P25-75).
ACPA: anticuerpos antipéptidos citrulinados; CVF: capacidad vital forzada; DLCO: capacidad de difusión del CO; FR: factor reumatoide; NINE: neumonía intersticial no específica; NIU: neumonía intersticial usual.
En negrita se expresan los datos estadísticamente significativos (p < 0,05).
En nuestro estudio se ha estimado una prevalencia de EPID en AR que es menor de la descrita en otras series17, confirmándose que esta enfermedad es más frecuente en fumadores y pacientes con FR y ACPA positivos y que la NIU es el patrón más frecuente.
Aunque el estudio es de un solo centro, se trata de un área representativa amplia en la que los pacientes con AR son derivados en su casi totalidad a Reumatología (con una prevalencia de AR del 0,62 [IC del 95%: 0,60-0,64] según datos propios, que cuadra con la estimada para la población general). Además, los pacientes atendidos en la consulta interdisciplinar provienen tanto de la consulta de Reumatología del hospital como de los centros de especialidades, por lo que incluyen pacientes con AR con todo el espectro de gravedad de la enfermedad. Por último, sus características clínicas son muy similares a las de otras series, lo que apoya su representatividad.
La prevalencia de EPID en pacientes con AR varía del 1 al 67,3%17. Estas diferencias no son sorprendentes, por la gran cantidad de definiciones, pruebas diagnósticas utilizadas18, criterios19 e incluso debido al análisis estadístico utilizado, no reflejado siempre en los artículos19. La prevalencia es del 1 al 6% si se utiliza radiografía de tórax y del 5 al 67,3% si se realiza TCAR20.
Hay que considerar que, aunque la proporción de pacientes con AR-EPID por TCAR es llamativa, solo se considera clínicamente significativa en el 5-10%21. Esto debe tenerse en cuenta, ya que existe una brecha significativa entre el gran número de individuos asintomáticos con cambios pulmonares radiológicos o funcionales y el de pacientes que finalmente desarrollará una EPID clínica22. Kelly et al.23 realizaron un estudio en pacientes sintomáticos y diagnosticados por TCAR y obtuvieron un resultado del 2-3% y, en un trabajo que incluía a pacientes con pleuritis o EPID, Bartels et al. publicaron unos resultados del 2% en 1985 y del 4% en el 200618.
En España los únicos datos que disponemos de prevalencia de EPID en AR son los de la cohorte EMECAR5, con una prevalencia de 3,7% (IC del 95%: 2,4-5). En este estudio los criterios de clasificación consistían en existencia de patrón restrictivo o hallazgos en TCAR indicativos de EPID, pero sin hacer referencia a la clínica. Aunque recientemente se han publicado estudios descriptivos de AR-EPID en nuestro país6,7, no hemos localizado otros trabajos que estimaran su prevalencia.
La prevalencia de AR-EPID sintomática en nuestra área es del 1,72% (IC del 95%: 1,26-2,29), comparable con los resultados de EMECAR5 y con los del trabajo de Kelly et al.23 Nuestro trabajo solo incluye a pacientes con síntomas respiratorios en los que hemos confirmado EPID mediante TCAR. Esto supone que nuestro estudio puede subestimar la prevalencia de AR-EPID. Además, el hecho de no seleccionar solo a pacientes con AR grave también puede ser una explicación de esta baja prevalencia.
En la AR, la afectación pulmonar es la primera manifestación en el 10-20% de los pacientes3, datos que coinciden con nuestros resultados, donde 10 pacientes (10%) iniciaron con clínica respiratoria. El inicio de la afectación pulmonar en la AR habitualmente ocurre hacia los 50-60 años24 y la edad se considera un factor de riesgo de desarrollo de EPID. Por otro lado, la edad al diagnóstico de AR también se ha relacionado con EPID22. En nuestra serie, la edad media al diagnóstico de la AR fue 57 años. Llama la atención que la prevalencia de EPID sea más elevada en menores de 55 años que en los mayores, si bien estas diferencias no son estadísticamente significativas.
Se ha descrito que, además de la edad, el tabaquismo, el FR y los ACPA positivos, especialmente a títulos altos, los antecedentes familiares de AR y ser varón son factores de riesgo de desarrollo de EPID en la AR23,25-27. En nuestra serie, el 61% de los pacientes tenía antecedentes de tabaquismo y más del 80% tenía FR y ACPA positivos a títulos altos, lo cual cuadra con lo esperado.
En las enfermedades sistémicas inmunomediadas el patrón NINE es el más frecuente excepto en la AR, donde es el NIU19. En nuestro trabajo, es más frecuente la NIU (31,1%), seguida de NINE (22,2%), con un patrón similar a otras publicaciones, con cifras entorno al 40-60% para NIU y al 11-30% para NINE4. Cada vez hay más datos que confirman que los pacientes con AR y patrón NIU tienen un fenotipo diferente que los pacientes con patrones no NIU. La NIU es más frecuente en varones, mayores, fumadores3, mientras que el patrón NINE es casi 3veces más frecuente en mujeres28. Como en otros trabajos, los pacientes con NIU o probable NIU son más mayores al diagnóstico (p=0,039), son hombres con más frecuencia (48,5 vs. 30%) y existe más el antecedente de tabaquismo que en el grupo NINE (53,1 vs. 40%).
La mayoría de los estudios sobre EPID en las enfermedades autoinmunes no han tenido en cuenta su coexistencia con enfisema, por lo que no se conoce la frecuencia de SCEF en estas enfermedades29. En nuestro estudio, el 13,3% de los pacientes muestran patrón de SCEF. También hemos podido comprobar que se trata de pacientes con un fenotipo especial; en nuestro trabajo todos eran varones, fumadores y mayores de 55 años.
Este trabajo tiene algunas limitaciones. En la estratificación por edad hemos empleado la aportada por los registros de Atención Primaria, lo que puede suponer una limitación, dado que el límite de 55 años es distinto de otras series y no permite comparaciones. Si bien el trabajo se ha llevado a cabo en un solo centro, pensamos que la muestra es suficientemente representativa para que estos datos puedan ser extrapolables a otras zonas. La fortaleza fundamental de este estudio es que los pacientes se han reclutado desde una consulta interdisciplinar, en la que existe una protocolización del diagnóstico y seguimiento, con lo que se han conseguido unos datos muy uniformes.
ConclusionesCon este estudio unicéntrico hemos analizado la prevalencia de AR-EPID sintomática en nuestra área, la cual está por debajo del 2%, mucho menor de la descrita en otros trabajos, probablemente en relación con las definiciones utilizadas. Así mismo, hemos descrito que en nuestro medio el patrón NIU es el más frecuente en pacientes con AR, seguido del NINE y analizado por primera vez la prevalencia de SCEF en la AR, que alcanza el 13%.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés relacionado directa o indirectamente con los contenidos del manuscrito.
Agradecemos la ayuda de David Malillos Pérez y Beatriz Becerril Rojas, técnicos de apoyo del área asistencial Norte, Gerencia Adjunta de Procesos Asistenciales, y al Instituto de Salud Musculoesquelética por la realización del análisis estadístico y la revisión crítica del manuscrito.