Determinar en la vida real los beneficios antropométricos y analíticos de la adición de semaglutida por vía subcutánea al tratamiento previo con insulina en pacientes con diabetes tipo 2.
MétodosEstudio descriptivo, retrospectivo y abierto en el que se describen características clínicas y antropométricas de 117 pacientes diagnosticados de diabetes tipo 2 seguidos en las consultas externas de Endocrinología y Nutrición del Hospital Universitario Central de Asturias a lo largo de 53 semanas tras el inicio de tratamiento con semaglutida subcutánea (octubre-diciembre 2019). Todos los pacientes estaban en tratamiento previo con insulina, con o sin antidiabéticos orales.
ResultadosDe los 117 pacientes iniciales, 17 no completaron el estudio debido a efectos adversos (náuseas, vómitos), decisión clínica y pérdida de seguimiento.
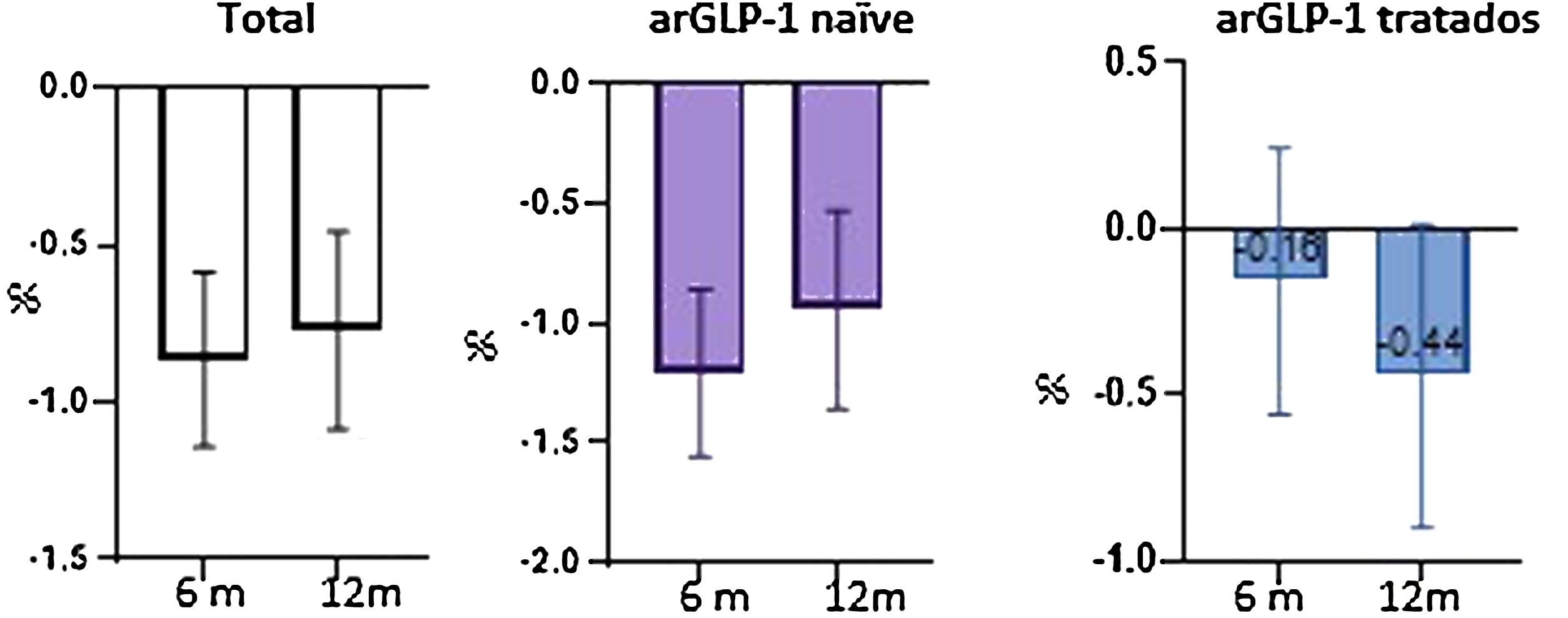
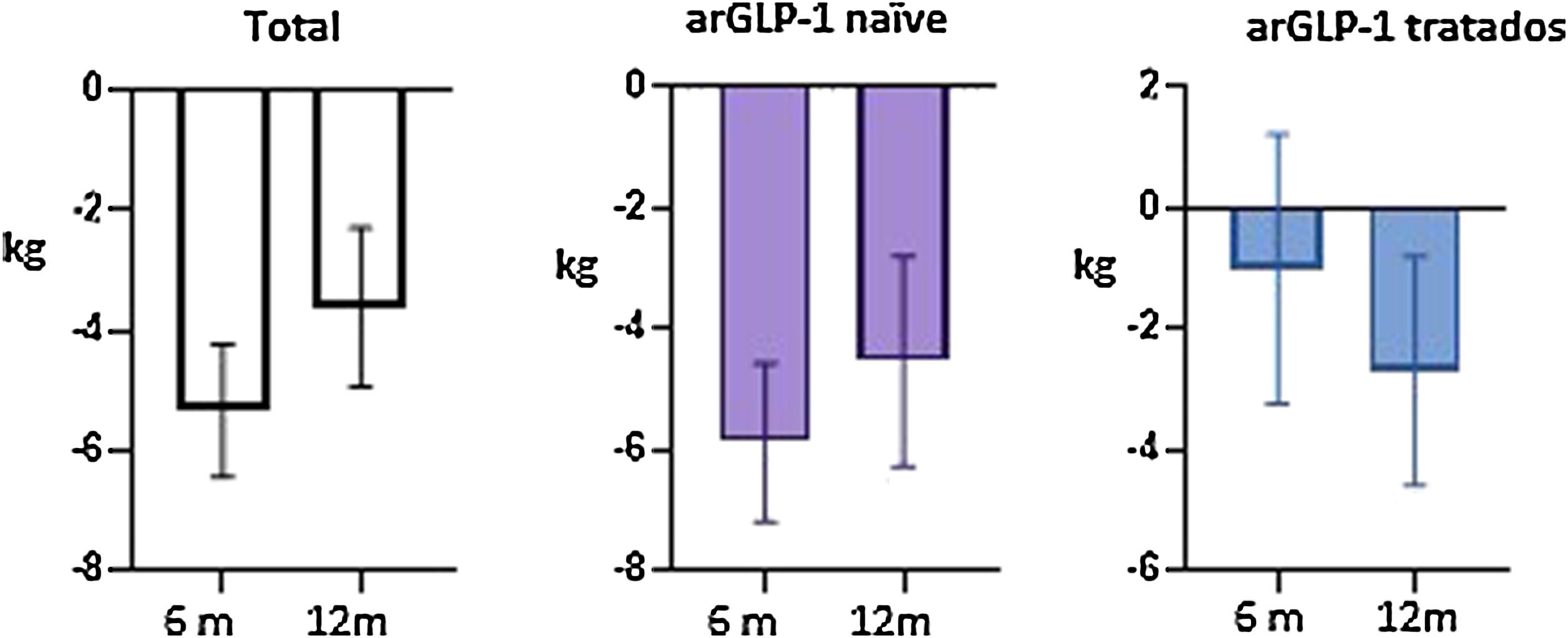
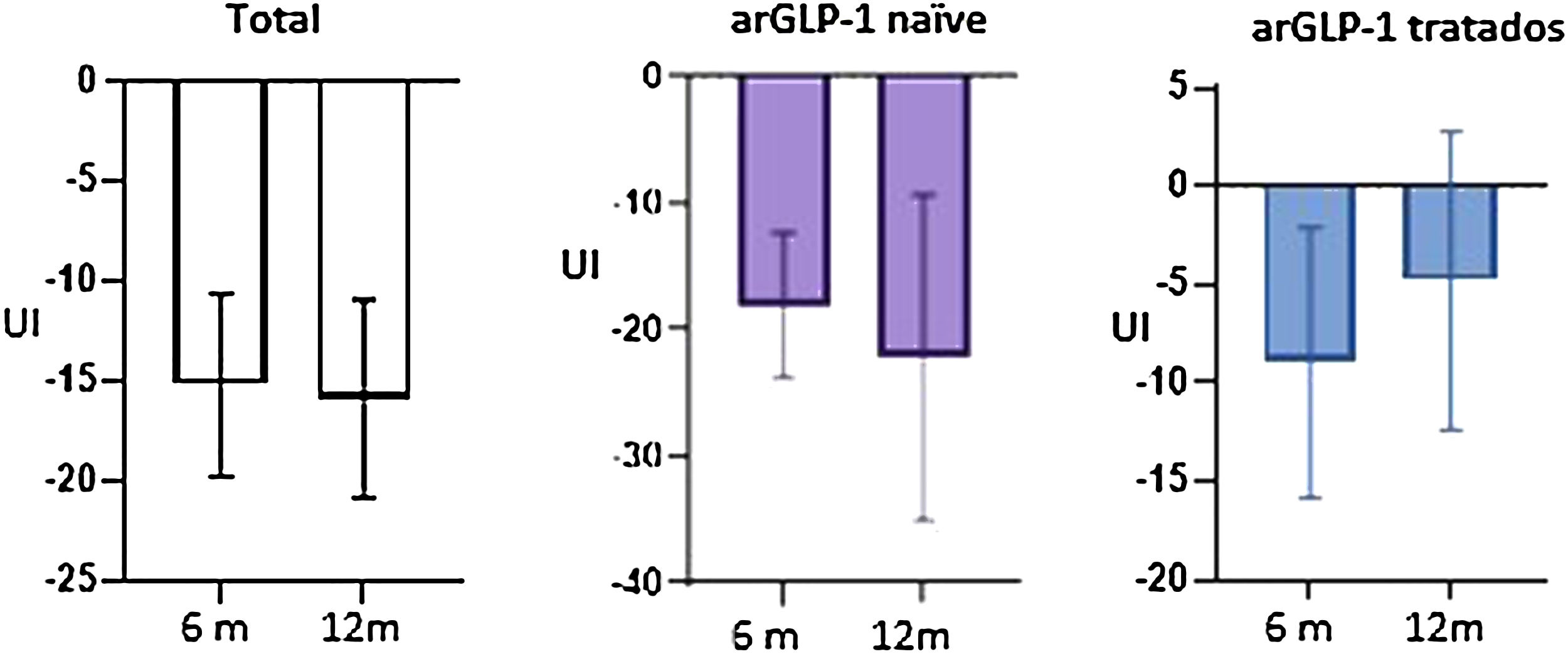
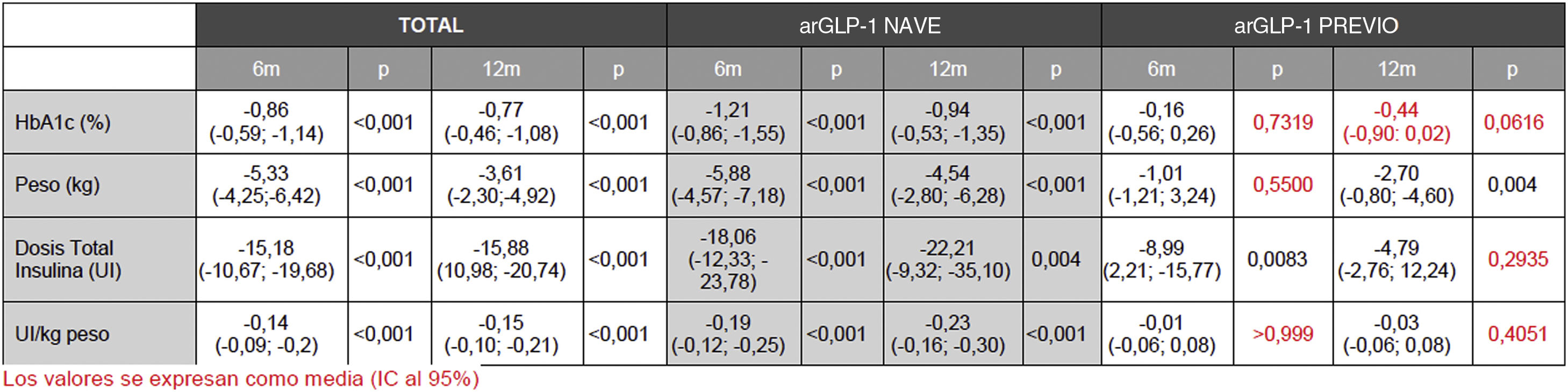
A los 12 meses (semana 53) del inicio de la semaglutida se obtuvo un descenso de HbA1c de 0,74% (IC 95% 0,59-1,14, p<0,05), así como de 3,61kg de peso (IC 95% 2,30-4,92, p<0,05), y de 15,88 UI de insulina total (IC 95% 10,98-20,74, p<0,05) respecto a las cifras basales. En pacientes sin análogo del receptor de GLP-1 (arGLP-1) previo, el efecto en la disminución de HbA1c, el peso y la dosis total de insulina fue estadísticamente significativo; sin embargo, los pacientes pretratados con arGLP-1 solo tuvieron mejoría en la reducción de peso. No se observaron eventos adversos graves.
ConclusionesLa adición de semaglutida subcutánea al tratamiento previo con insulina con o sin antidiabéticos orales induce una disminución de HbA1c, peso y dosis de insulina de forma segura. Este efecto es mayor en pacientes naïve para tratamiento con arGLP-1.
This work aims to determine the real-life anthropometric and analytical benefits of adding subcutaneous semaglutide to previous insulin treatment in patients with type 2 diabetes.
MethodsThis is a descriptive, retrospective, open-label study describing the clinical and anthropometric characteristics of 117 patients diagnosed with type 2 diabetes followed-up on in the Endocrinology and Nutrition outpatient clinic of the Hospital Universitario Central de Asturias for 53 weeks after starting treatment with subcutaneous semaglutide (October-December 2019). All patients were on previous insulin treatment with or without oral antidiabetics.
ResultsOf the 117 initial patients, 17 did not complete the study due to adverse effects (nausea, vomiting), the physician's decision, or loss to follow-up.
Twelve months (week 53) after starting semaglutide, there was a decrease in HbA1c of 0.74% (95% CI 0.59-1.14, p<0.05) as well as 3.61kg of weight loss (95% CI 2.30-4.92, p<0.05) and a decline in total insulin of 15.88 IU (95% CI 10.98-20.74, p<0.05) from baseline figures. In patients without prior GLP-1 receptor analogs (GLP-1ra), the effect in terms of a reduction in HbA1c, weight, and the total insulin dose was statistically significant. However, in patients pre-treated with GLP-1ra only had improvements in terms of weight loss. No serious adverse events were observed.
ConclusionsThe addition of subcutaneous semaglutide to prior insulin treatment with or without oral antidiabetics safely led to a decrease in HbA1c, weight, and the insulin dose. This effect is greater in GLP-1ra naive patients.
Artículo
Diríjase desde aquí a la web de la >>>FESEMI<<< e inicie sesión mediante el formulario que se encuentra en la barra superior, pulsando sobre el candado.
Una vez autentificado, en la misma web de FESEMI, en el menú superior, elija la opción deseada.

>>>FESEMI<<<