La heterogeneidad de los pacientes con insuficiencia cardíaca y fracción de eyección preservada (ICFEP) es elevada, por lo que se tiende a agrupar en fenotipos para intervenir con precisión. Dentro de estos, los pacientes con diabetes mellitus (DM) mantienen esta heterogeneidad. Nuestro objetivo es describir grupos de pacientes con ICFEP y DM basados en otras comorbilidades.
Material y métodosLos pacientes se reclutan desde el registro nacional de insuficiencia cardíaca (RICA). Se incluyen pacientes con fracción de eyección mayor o igual al 50% sin valvulopatía y con DM. Se realiza un análisis aglomerativo jerárquico con el método de Ward incluyendo las siguientes variables: dislipemia, hepatopatía, EPOC, demencia, enfermedad cerebrovascular, arritmia, presión arterial sistólica, índice de masa corporal (IMC), estimación del filtrado glomerular y hemoglobina.
ResultadosSe incluyen 1.934 pacientes con ICFEP, de los que 907 (46,9%) tenían DM, con predominio de mujeres (60,9%) y con un IMC de 31,1 (5,9) kg/m2. Se obtienen 4 grupos: dos con elevado riesgo vascular (uno con arritmia y otro no), con 263 pacientes el primero y 201 el segundo, otro con predominio de EPOC (140 pacientes) y un último grupo de 303 pacientes con más edad pero menos comorbilidad.
ConclusionesEn nuestros pacientes con ICFEP y DM predomina la obesidad y el sexo femenino. Los cuatro grupos ofrecen oportunidades de tratamiento para mejorar su pronóstico no solo basadas en la utilización de nuevos fármacos antidiabéticos sino por otras opciones que pueden suponer un punto de partida para nuevas investigaciones.
The heterogeneity of patients with heart failure and preserved ejection fraction (HFpEF) is high, thusthis entity tends to be grouped into phenotypes to act with precision. Within these groups, patients with type 2 diabetes mellitus (T2DM) hold this heterogeneity. Our aim is to describe subgroups of patients with HFpEF and T2DM based on other comorbidities.
Material and MethodsPatients were recruited from the national registry of heart failure (RCIA). Patients with ejection fraction greater than or equal to 50% without valvular disease and with T2DM were included. A hierarchical agglomerative analysis was performed with Ward's method including the following variables: dyslipidemia, liver disease, Chronic obstructive pulmonary disease (COPD), dementia, cerebrovascular disease, arrhythmia, systolic blood pressure, body mass index (BMI), estimation of glomerular filtration and hemoglobin.
Results1934 patients with ICFEP were included, of which 907 (46.9%) had T2DM with a predominance of women (60.9%) and with a BMI of 31.1 (5.9) Kg / m2. Four groups were obtained, two with high vascular risk (one with arrhythmia and the other without it) with 263 patients the first and 201 the second. A third group had a predominance of COPD (140 patients) and a last group with 303 patients older but with less comorbidity.
ConclusionsIn our patients with ICFEP and T2DM, obesity and female sex predominated. All four groups offered treatment chances to improve their prognosis not only based on the use of new antidiabetic drugs but also on other options that may be a starting point for further research.
La insuficiencia cardíaca (IC) con fracción de eyección preservada (ICFEP) es un síndrome clínico resultante del aumento de la resistencia al llenado del ventrículo izquierdo durante la diástole que da lugar a síntomas congestivos1. Aunque el conocimiento de su fisiopatología se ha venido ampliando en los últimos años, aún se desconocen muchos aspectos de la ICFEP, como la utilidad de marcadores consistentes, su patogénesis en poblaciones específicas o los tratamientos que demuestren beneficios en estos pacientes.
La ICFEP se considera un proceso heterogéneo con múltiples fenotipos2,3, algunos de ellos relacionados con las comorbilidades subyacentes. Entre estas comorbilidades, la diabetes mellitus tipo2 (DM2) es una de las más importantes; está presente en aproximadamente el 45% de estos pacientes, y esta prevalencia se incrementa en los casos de nuevo diagnóstico de ICFEP4. Además, la presencia de DM2 se asocia a un incremento del riesgo de morbimortalidad en pacientes con ICFEP, aunque en menor grado que en pacientes con IC y fracción de eyección reducida (ICFER)5. Un problema añadido es que los pacientes con DM2 e ICFEP presentan a menudo otras comorbilidades, como hipertensión arterial, dislipemia, obesidad, enfermedad pulmonar obstructiva crónica (EPOC) o fibrilación auricular, que también influyen en el pronóstico6. Se está tratando de analizar en qué medida estas comorbilidades influyen en la ICFEP, determinando cómo se agrupan dichas comorbilidades en diversos fenotipos sobre los que se podría intervenir para conseguir una mejoría clínica y pronóstica de estos pacientes2,6,7. Sin embargo, las cohortes existentes de pacientes con ICFEP son escasas y la DM2 suele incluirse como una comorbilidad más en los análisis.
Nuestro objetivo en el presente estudio es describir los diversos fenotipos de comorbilidades asociadas, tanto cardiovasculares como no cardiovasculares, que pueden presentarse en los pacientes con ICFEP y DM2. Nuestra hipótesis es que la ICFEP con DM2 es una entidad heterogénea en base a las comorbilidades acompañantes, sobre la que se pueden establecer diversos conglomerados (clusters) de comorbilidades que sirvan de punto de partida para investigar y tratar de una forma más precisa a estos pacientes.
Material y métodosLos pacientes se reclutaron a partir del Registro Nacional de Insuficiencia Cardíaca (RICA), perteneciente al Grupo de Trabajo de Insuficiencia Cardíaca y Fibrilación Auricular de la Sociedad Española de Medicina Interna (SEMI). Este registro es multicéntrico, prospectivo y se mantiene activo desde el año 2008. Incluye, de forma única y consecutiva, a pacientes mayores de 50años con diagnóstico de IC al alta hospitalaria por IC descompensada o de nueva aparición, según las guías europeas de Cardiología vigentes en cada momento8. Estos pacientes, una vez incluidos, son seguidos durante un año. El presente análisis recoge los datos de pacientes incluidos desde mazo de 2008 hasta mayo de 2017. En este tiempo se han publicado diversos análisis surgidos desde el registro9,10.
El protocolo del registro fue aprobado por el comité ético del Hospital Universitario Reina Sofía de Córdoba, y todos los pacientes han de firmar un consentimiento informado previamente a su inclusión en el registro. Los datos se recogen a partir de una página web (www.registrorica.org) que contiene la base de datos y a la que se accede a través de claves personalizadas.
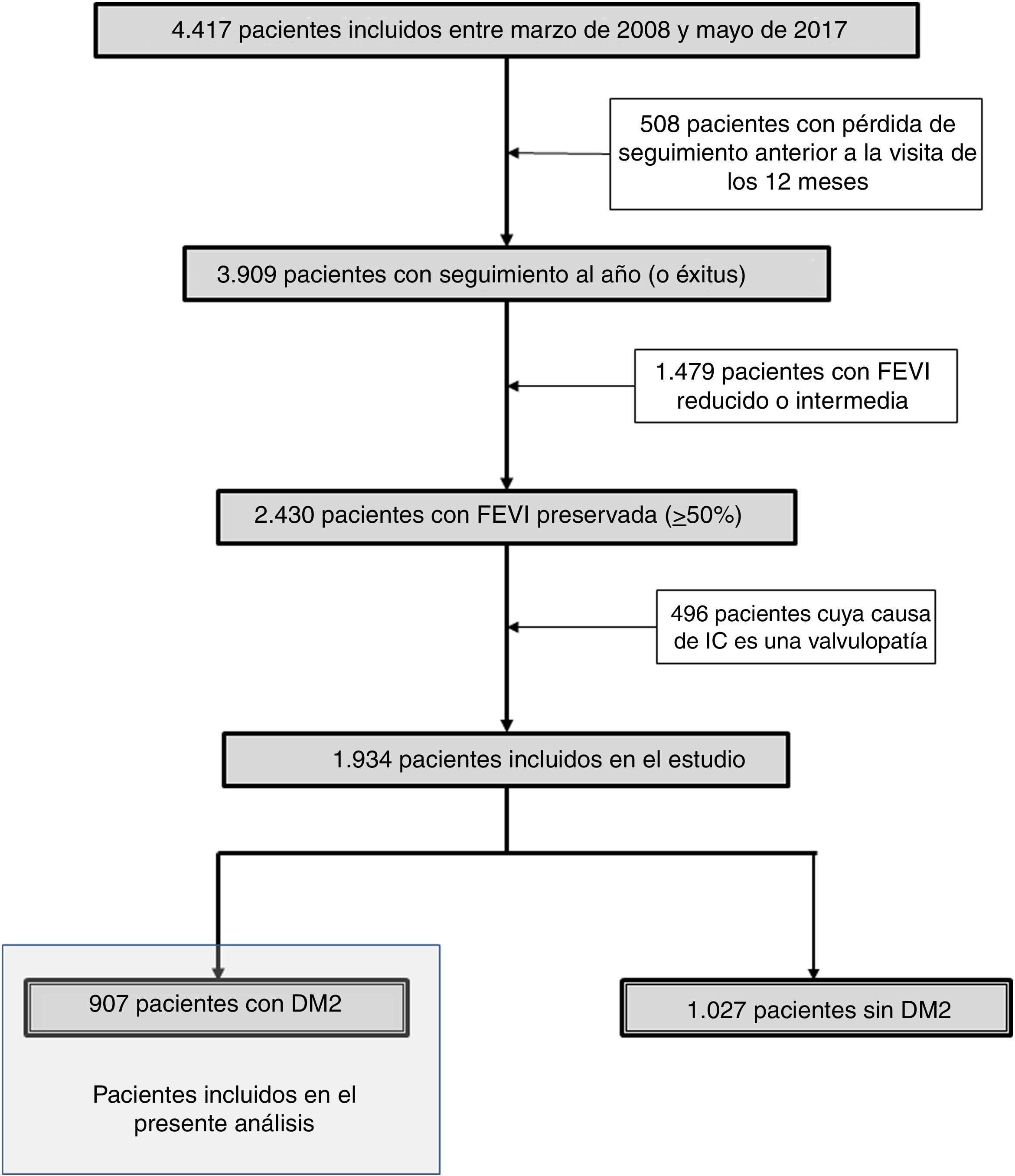
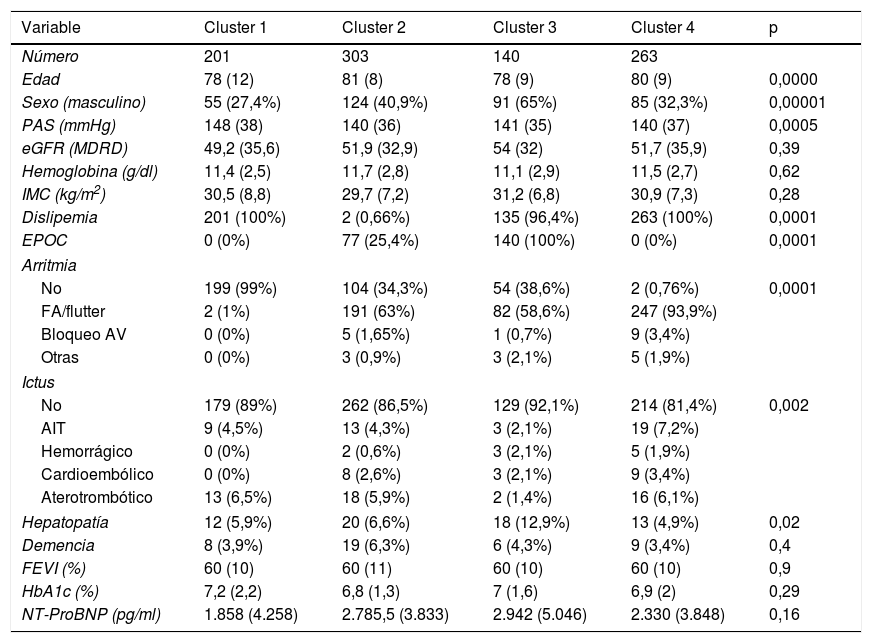
En el presente análisis se incluyeron de manera exclusiva los pacientes con una fracción de eyección del ventrículo izquierdo (FEVI) mayor o igual al 50%, excluyendo a los pacientes con IC secundaria a valvulopatías (fig. 1). Se han utilizado datos procedentes de antecedentes personales, de exploración física (presión arterial sistólica, peso y talla) y analíticos (hemoglobina, estimación del filtrado glomerular [eGFR] por la fórmula MDRD, hemoglobina glucosilada [HbA1c] y péptidos natriuréticos). La evaluación de la FEVI se realizó mediante ecocardiograma2D.
De la muestra total de pacientes con ICFEP se seleccionaron los pacientes con diagnóstico de DM2, basándose en los antecedentes del paciente o si este estaba tomando tratamiento con agentes antidiabéticos. Se excluyeron del análisis los pacientes que no tuvieran completas las variables a estudiar, los que no completaron el seguimiento y los que fallecieron durante la hospitalización.
Una vez obtenida la muestra final, la población se subdividió en función del número de clusters de comorbilidad obtenidos en el análisis estadístico.
El objetivo primario del estudio fue describir las características de cada cluster de comorbilidades y las diferencias existentes entre dichos clusters.
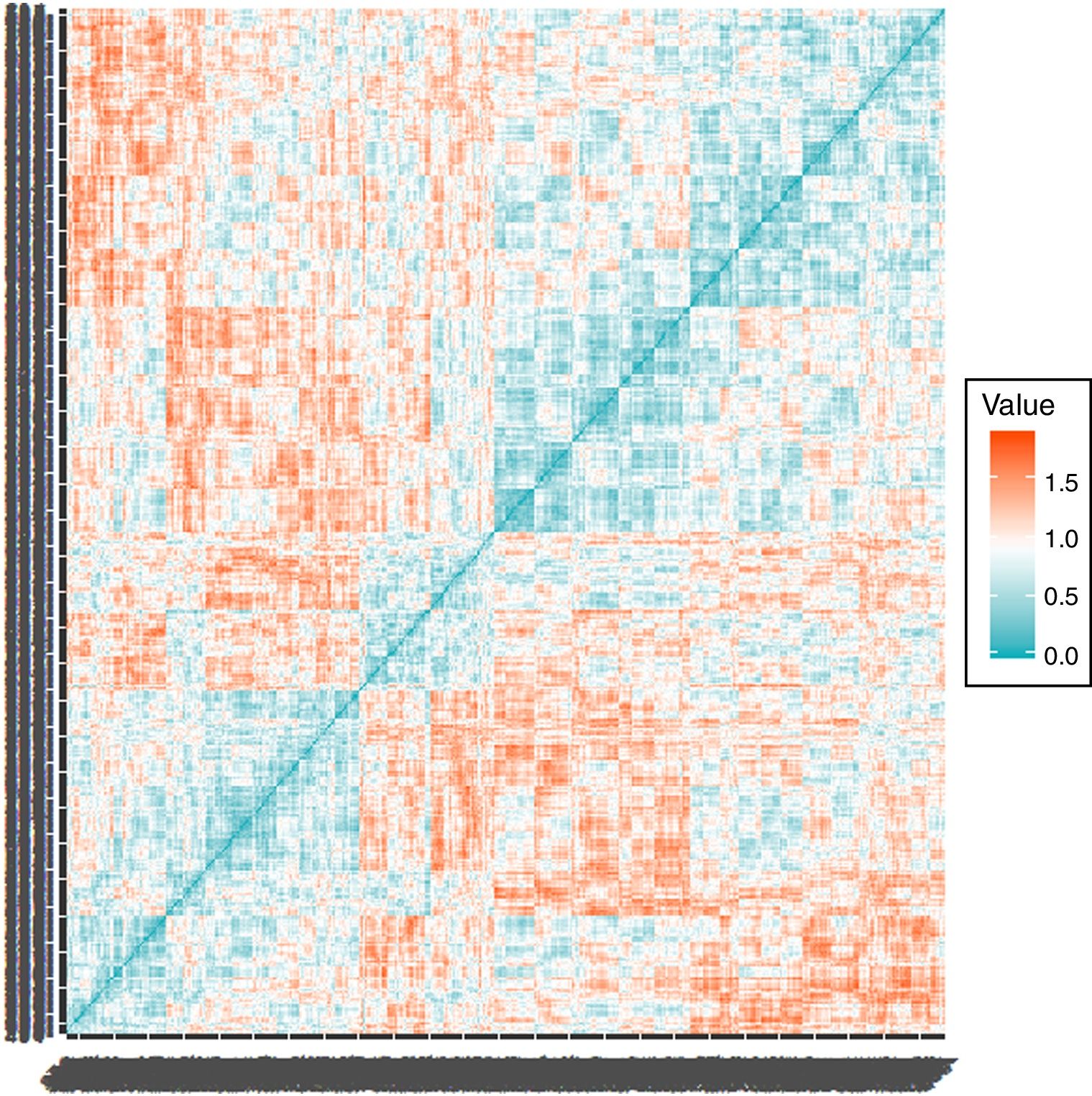
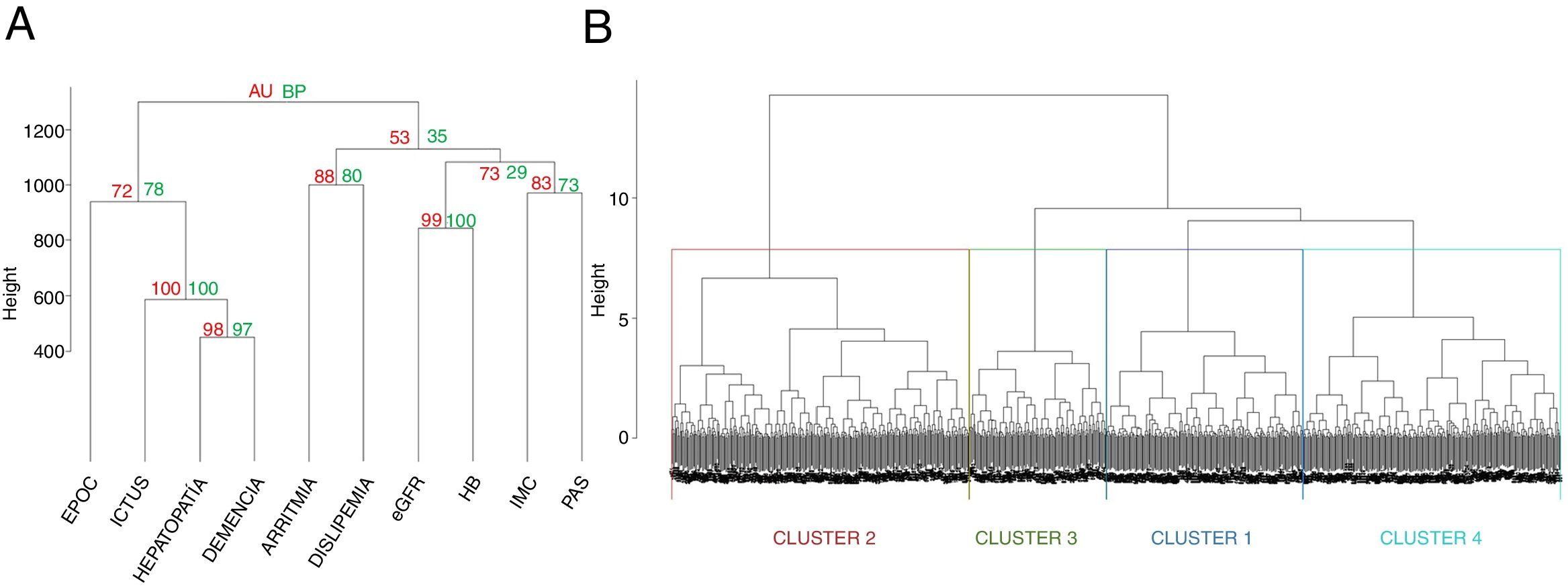
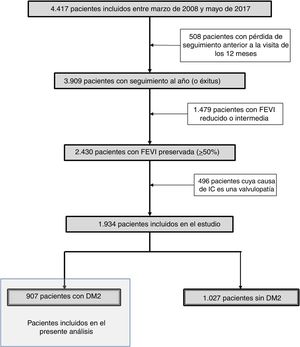
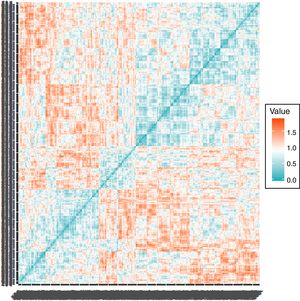
Análisis estadísticoPara la obtención de los clusters utilizamos el análisis aglomerativo jerárquico con el método de Ward, usando la función hclust del programa estadísticoR (versión 3.5.1)11. Este estudio contempla el análisis de pacientes que comparten características similares basadas en las variables referidas, que se van agrupando de forma puntual (inicialmente habría tantos grupos como individuos), construyendo progresivamente una jerarquía de los grupos, en nuestro caso de una forma ascendente, es decir, cada observación comienza en su propio grupo y los pares de grupos son mezclados mientras uno sube en le jerarquía. Esto permite la construcción de un árbol de clasificación (dendrograma). Las variables pre-especificadas para realizar el análisis se han escogido en base a su disponibilidad en el registro, a estudios previos y a la experiencia clínica, y fueron: a)variables cualitativas dicotómicas (EPOC, dislipemia, hepatopatía y demencia), a las que se adjudicó el valor1 cuando estaban presentes y 0 cuando estaban ausentes; b)variables cualitativas no dicotómicas, como el ictus (ausente0, accidente isquémico transitorio [AIT]1, ictus hemorrágico2, ictus cardioembólico3, ictus aterotrombótico4) y las arritmias (ritmo sinusal0, flutter/fibrilación auricular1, bloqueo auriculoventricular2, otras3), y c)variables cuantitativas (presión arterial sistólica, índice de masa corporal [IMC], eGFR y hemoglobina), que se analizaron según su valor numérico. Se construyó inicialmente una matriz de (di)similaridad entre las observaciones mediante el método de Kendall usando la función factoextra de R, dado que las variables no son paramétricas, siendo el nivel de color proporcional al valor de similaridad entre las observaciones: si es rojo, la distancia entre las variables es0 (alta similaridad); si es verde, la distancia es alta (baja similaridad) (fig. 2). Una vez obtenido el dendrograma, para escoger los clusters más adecuados se utilizaron técnicas de remuestreo mediante bootstrap (n=1.000) con la función pvclust de R12. Para cada potencial cluster se calculó el valor de probabilidad del bootstrap (bootstrap probability [BP]), que se corresponde con la frecuencia con la que el mismo cluster es detectado en los diferentes remuestreos. De la misma forma, para cada cluster se calcularon los valores de probabilidad aproximada sin sesgos (approximately unbiased probability [AU]). Los clusters con un AU del 95% se consideraron fuertemente respaldados por los datos. Ha sido en base a los mayores valores posibles de BP y AU (fig. 3A) que se han escogido los cuatro grupos del presente estudio. Una vez obtenidos los grupos y clasificados los pacientes según los mismos, las variables cualitativas se expresaron mediante el número absoluto y porcentaje y se compararon mediante chi cuadrado. Las variables cuantitativas se expresaron mediante su mediana y rango intercuartílico, comparándose mediante Kruskal-Wallis por ser variables no paramétricas (analizado con Saphiro-Wilk). Un valor de p<0,05 se consideró significativo. El análisis se realizó igualmente con el programaR (versión 3.5.1).
Matriz de similaridad de los clusters realizada mediante el método de Kendall. El nivel de color es proporcional al valor de similaridad entre las observaciones: si es rojo, la distancia entre las variables es 0 (alta similaridad); si es verde, la distancia es alta (baja similaridad).
Dendrograma resultante del análisis aglomerativo jerárquico. A)Dendrograma esquematizado resultante, con los grados de significación por comorbilidades. En verde, BP (bootstrap probability); en rojo, AU (approximately unbiased probability). B)Dendrograma resultante del análisis. En colores se marcan los cluster escogidos.
eGFR: estimación del filtrado glomerular; HB: hemoglobina; IMC: índice de masa corporal; PAS: presión arterial sistólica.
Un total de 1.934 pacientes presentaban ICFEP, de los cuales 907 (46,9%) tenían DM2 (fig. 1). La edad media fue de 78,5 (7,7) años, con predominio del sexo femenino (n=552, 60,9%). La FEVI media fue de 61,1 (7,9) % y el eGFR medio fue de 55,6 (26,6) ml/min/1,73m2. Las comorbilidades más prevalentes fueron la dislipemia (n=601, 66,3%), la fibrilación auricular/flutter (n=522, 57,5%) y la EPOC (n=217, 23,9%).
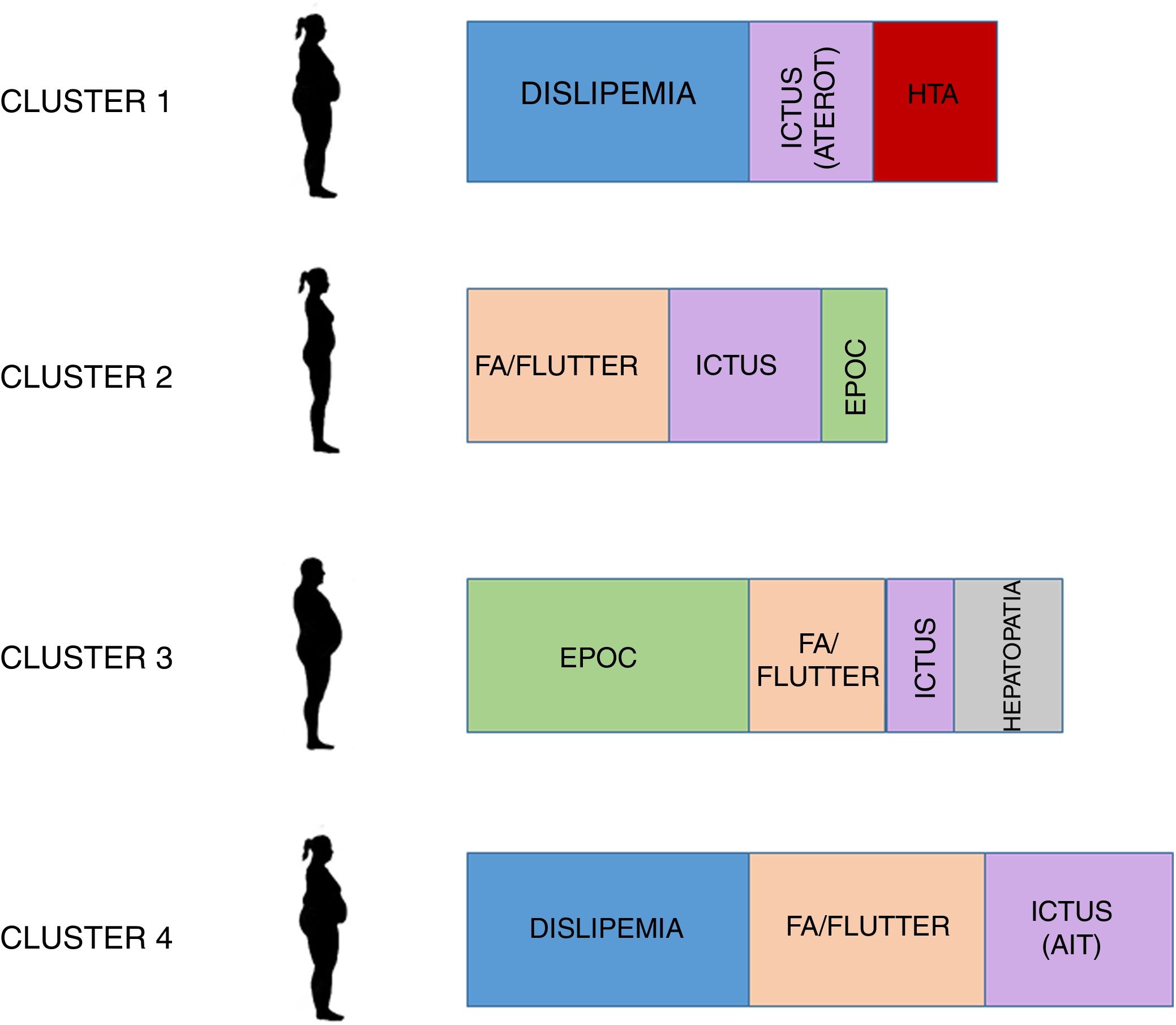
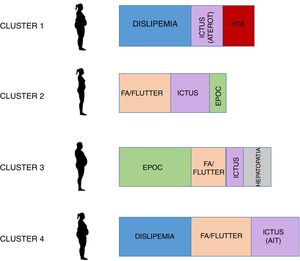
El dendrograma resultante del análisis de clusters se muestra en la figura 3B. Se construyeron 4 clusters cuyas características se muestran en la tabla 1 y en la figura 4. Como se puede observar, el cluster número1 (n=201, 22,2%) incluía a pacientes con elevado riesgo cardiovascular sin arritmia (solo un 1% presentaban fibrilación auricular/flutter), predominando las mujeres con presión arterial sistólica (PAS) elevada, dislipemia y un elevado porcentaje de ictus aterotrombóticos.
Comparaciones entre los clusters
| Variable | Cluster 1 | Cluster 2 | Cluster 3 | Cluster 4 | p |
|---|---|---|---|---|---|
| Número | 201 | 303 | 140 | 263 | |
| Edad | 78 (12) | 81 (8) | 78 (9) | 80 (9) | 0,0000 |
| Sexo (masculino) | 55 (27,4%) | 124 (40,9%) | 91 (65%) | 85 (32,3%) | 0,00001 |
| PAS (mmHg) | 148 (38) | 140 (36) | 141 (35) | 140 (37) | 0,0005 |
| eGFR (MDRD) | 49,2 (35,6) | 51,9 (32,9) | 54 (32) | 51,7 (35,9) | 0,39 |
| Hemoglobina (g/dl) | 11,4 (2,5) | 11,7 (2,8) | 11,1 (2,9) | 11,5 (2,7) | 0,62 |
| IMC (kg/m2) | 30,5 (8,8) | 29,7 (7,2) | 31,2 (6,8) | 30,9 (7,3) | 0,28 |
| Dislipemia | 201 (100%) | 2 (0,66%) | 135 (96,4%) | 263 (100%) | 0,0001 |
| EPOC | 0 (0%) | 77 (25,4%) | 140 (100%) | 0 (0%) | 0,0001 |
| Arritmia | |||||
| No | 199 (99%) | 104 (34,3%) | 54 (38,6%) | 2 (0,76%) | 0,0001 |
| FA/flutter | 2 (1%) | 191 (63%) | 82 (58,6%) | 247 (93,9%) | |
| Bloqueo AV | 0 (0%) | 5 (1,65%) | 1 (0,7%) | 9 (3,4%) | |
| Otras | 0 (0%) | 3 (0,9%) | 3 (2,1%) | 5 (1,9%) | |
| Ictus | |||||
| No | 179 (89%) | 262 (86,5%) | 129 (92,1%) | 214 (81,4%) | 0,002 |
| AIT | 9 (4,5%) | 13 (4,3%) | 3 (2,1%) | 19 (7,2%) | |
| Hemorrágico | 0 (0%) | 2 (0,6%) | 3 (2,1%) | 5 (1,9%) | |
| Cardioembólico | 0 (0%) | 8 (2,6%) | 3 (2,1%) | 9 (3,4%) | |
| Aterotrombótico | 13 (6,5%) | 18 (5,9%) | 2 (1,4%) | 16 (6,1%) | |
| Hepatopatía | 12 (5,9%) | 20 (6,6%) | 18 (12,9%) | 13 (4,9%) | 0,02 |
| Demencia | 8 (3,9%) | 19 (6,3%) | 6 (4,3%) | 9 (3,4%) | 0,4 |
| FEVI (%) | 60 (10) | 60 (11) | 60 (10) | 60 (10) | 0,9 |
| HbA1c (%) | 7,2 (2,2) | 6,8 (1,3) | 7 (1,6) | 6,9 (2) | 0,29 |
| NT-ProBNP (pg/ml) | 1.858 (4.258) | 2.785,5 (3.833) | 2.942 (5.046) | 2.330 (3.848) | 0,16 |
AIT: accidente isquémico transitorio; Bloqueo AV: bloqueo auriculoventricular; eGFR: estimación por la fórmula MDRD del filtrado glomerular; EPOC: enfermedad pulmonar obstructiva crónica; FA/flutter: fibrilación o flutter auricular; FEVI: fracción de eyección del ventrículo izquierdo; HbA1c: hemoglobina glucosilada; IMC: índice de masa corporal; NT-ProBNP: prohormona N-terminal del péptido natriurético cerebral; PAS: presión arterial sistólica.
El cluster número 2 (n=303, 33,4%) incluía pacientes de mayor edad, igualmente con predominio del sexo femenino, metabólicamente más sanos (sin dislipemia y con PAS más baja) y con una tasa de fibrilación auricular/flutter superior al 50%.
El cluster número 3 (n=140, 15,4%) incluía pacientes mayoritariamente varones, con EPOC, dislipemia y hepatopatía. Aunque la presencia de fibrilación auricular/flutter fue del 58,6%, este cluster registró la menor tasa de enfermedad cerebrovascular.
Por último, el cluster número 4 (n=263, 29,0%) fue similar al número1, pero con mucha más presencia de fibrilación auricular/flutter (93,9%), de AIT (7,2%) y de ictus cardioembólicos (3,4%).
Aunque no se encontraron diferencias significativas relacionadas respecto al IMC, los clusters1, 3 y4 incluían pacientes obesos (IMC>30kg/m2), mientras que el cluster2 incluía a pacientes con sobrepeso (IMC entre 25 y 30kg/m2).
DiscusiónAtendiendo a nuestros resultados, definimos cuatro clusters de pacientes con ICFEP y DM2, en base a las comorbilidades asociadas. Existen dos grupos de pacientes (clusters1 y4), con predominio del sexo femenino, donde predominaban los factores de riesgo vascular, que se diferenciaban entre ellos por la presencia o ausencia de fibrilación/flutter auricular. En un tercer grupo (cluster3), de predominio masculino, predominó la enfermedad respiratoria y la afectación hepática. Un último grupo (cluster2) englobó a pacientes de mayor edad, predominantemente mujeres, con una elevada proporción de fibrilación/flutter auricular. Un hecho común a todos los grupos fue la presencia de sobrepeso u obesidad.
La identificación de fenotipos de ICFEP y DM2 con diferentes clusters de comorbilidad permitiría valorar la pertinencia de abordajes diferenciados en estos grupos concretos de pacientes, en aras de obtener un mayor beneficio terapéutico.
Tratándose de pacientes con DM2 e IC, la primera opción que emerge como tratamiento son los inhibidores del cotransportador SGLT2 (SGLT2i). Esta familia de fármacos ha demostrado reducción de la morbimortalidad cardiovascular, con una marcada disminución de las hospitalizaciones por IC y protección renal en pacientes con DM2 de alto riesgo cardiovascular13. Actualmente están en marcha ensayos clínicos específicos con SGLT2i en pacientes con ICFEP. Aunque las hipótesis sobre los mecanismos por los que los SGLT2i ejercen su beneficio cardiorrenal permanecen abiertas, se ha propuesto que la mayor disponibilidad de cuerpos cetónicos utilizables por el corazón14 y su acción sobre el intercambiador Na/H, que reduciría el Na citoplasmático y conllevaría una vasodilatación coronaria15, podrían ser mecanismos implicados. Además, en pacientes con ICFEP los SGLT2i han mostrado tener efectos beneficiosos sobre la función diastólica y la masa ventricular izquierda16,17.
Por otra parte, respecto a los clusters 1, 3 y4, en los que la obesidad es un denominador común, se podría plantear la posibilidad de incluir en el tratamiento antidiabético un análogo del receptor del glucagón-like péptido-1 (GLP-1ra). Estos fármacos, además de reducir el peso corporal, han demostrado beneficios a nivel cardiovascular (lo que los haría recomendables en los clusters1 y4), y además podrían ejercer un efecto positivo sobre la enfermedad pulmonar en los pacientes del cluster3, tal como se ha demostrado en modelos animales18. En los ensayos clínicos de seguridad cardiovascular los GLP-1ra han mostrado un efecto neutro sobre la IC19,20, pero sus efectos sobre el remodelado ventricular, la rigidez arterial y el estrés oxidativo21 los hace potencialmente útiles en el tratamiento de la ICFEP. Aunque en el estudio LIVE, realizado en pacientes con ICFER, con y sin diabetes, el tratamiento con liraglutida, en comparación con placebo, no mostró beneficios clínicos y sí una mayor tendencia a efectos adversos cardiovasculares22, en este mismo ensayo se mostró un descenso significativo en el ratio E/e’ que confirmaría esta posible utilidad en el caso de la ICFEP.
Los inhibidores de la enzima DPP-4 (iDPP-4) han mostrado efectos dispares sobre la IC. Mientras que sitagliptina y linagliptina en sus respectivos ensayos clínicos de seguridad vascular demostraron ser neutros23,24, saxagliptina incrementó significativamente el riesgo de hospitalizaciones por IC25, mientras que alogliptina mostró un incremento no significativo26. Vildagliptina en el estudio VIVIDD27 no mostró modificaciones en la FEVI, aunque se objetivaron incrementos significativos de los volúmenes telediastólico y sistólico del ventrículo izquierdo. Por otra parte, sitagliptina ha mostrado atenuar el empeoramiento de la disfunción diastólica (ratio E/e’) en pacientes con DM228. Los iDPP-4 ofrecen una buena seguridad en poblaciones más ancianas29, lo que favorecería su uso en el cluster2, que contiene a los pacientes de más edad.
Aparte del abordaje de la DM2, estos clusters ofrecen otras oportunidades de personalización del tratamiento de los pacientes con ICFEP.
Aunque las estatinas son los fármacos de elección para el tratamiento de la dislipemia en pacientes con DM230, su papel en la IC resulta controvertido. La inhibición de la coenzima Q10, el déficit de selenio y el aumento de la calcificación arterial son algunos de los posibles mecanismos que podrían empeorar la IC31. En los pacientes de los clusters1 y4, en los que la dislipemia es altamente prevalente, se podría considerar el uso de otros fármacos hipolipemiantes (ezetimiba o inhibidores de PCSK9) sin esos potenciales efectos adversos.
Por otro lado, se sabe que la frecuencia cardíaca elevada es perjudicial para los pacientes con ICFEP en ritmo sinusal32. Sin embargo, existe controversia sobre la eficacia de los betabloqueantes en la ICFEP, independientemente del ritmo cardiaco (sinusal o fibrilación auricular)33. Ivabradina, en un ensayo clínico en el que el 75% de los pacientes tenían además betabloqueantes, demostró mejorar el control de la frecuencia cardíaca en pacientes con ICFEP, sin modificar el patrón diastólico (E/e’) ni el test de la marcha de seis minutos a los 8meses de tratamiento34. En un estudio previo, con un menor porcentaje de pacientes con betabloqueantes y un seguimiento más corto, ivabradina demostró mejorar la capacidad de ejercicio y disminuir las presiones de llenado del ventrículo izquierdo inducidas por ejercicio en pacientes con ICFEP35. Por ello, podría considerarse un tratamiento preferente de la ivabradina en el cluster3, donde los betabloqueantes podrían perjudicar la evolución de la EPOC. En este mismo cluster, y en pacientes con fibrilación auricular, se podría asimismo valorar la utilidad del diltiazem, que ha demostrado aumentar el volumen telediastólico en pacientes con miocardiopatía hipertrófica36.
El presente estudio tiene, no obstante, algunas limitaciones. Los pacientes incluidos pueden no ajustarse a la definición actual de ICFEP, dado que algunos fueron incluidos previamente a la publicación de los actuales criterios diagnósticos, y por tanto no todos los pacientes disponen de medidas concretas en el ecocardiograma ni de péptidos natriuréticos. No hemos incluido en el análisis algunas comorbilidades discordantes de la DM2 (p.ej., depresión) que pueden tener un impacto clínico significativo37. Al tratarse de un estudio transversal, no se ha analizado la evolución y las características pronósticas de cada cluster. Por último, se trata de un estudio de cohortes, que puede estar sujeto a diferentes sesgos de selección o de aleatorización.
En conclusión, el presente análisis describe diferentes grupos de pacientes con ICFEP en función de sus comorbilidades, pudiendo ser un punto de partida para futuras investigaciones que ayuden a definir con mayor precisión los diferentes clusters de comorbilidad y permitan realizar un abordaje terapéutico más integrador y personalizado que mejore el pronóstico de estos pacientes.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses.
Nuestro reconocimiento a todos los investigadores que forman parte del Registro RICA. Agradecemos al Centro Coordinador del Registro RICA «S&H Medical Science Service» el control de calidad de los datos y su apoyo logístico y administrativo.
Álvarez Rocha P., Anarte L., Arévalo-Lorido J.C., Cabanes Hernández Y., Carrascosa S., Carretero Gómez J., Cepeda J.M., Conde-Martel A., Dávila Ramos M.F., Díaz de Castellví S., Epelde F., Formiga F., García Escrivá D., Gómez Huelgas R., González Franco A., Josa Laorden C., León A., Llàcer P., López-Castellanos G., Lorente Furió O., Manzano L., Martínez Fernández R., Montero-Pérez-Barquero M., Ormaechea G., Pérez-Silvestre J., Quirós López R., Rodríguez Ávila E.E., Romero Requena J.M., Rubio Gracia J., Rugeles Niño J.P., Ruiz Laiglesia F., Ruiz Ortega R., Salamanca Bautista M.P., Serrado Iglesias A., Soler Rangel M.L., Suárez-Pedreira I., Trullàs J.C.