343 - DIAGNÓSTICO MICROBIOLÓGICO DE LAS PRINCIPALES PARASITOSIS IMPORTADAS EN ESPAÑA: PALUDISMO Y ENFERMEDAD DE CHAGAS
1Facultad de Medicina, Universidad de Granada, Granada. 2Servicio de Medicina Interna, Hospital de Barbastro, Barbastro (Huesca). 3Servicio de Enfermería, Hospital Royo Villanova, Zaragoza. 4Servicio Medicina Interna, Hospital Reina Sofía, Córdoba.
Objetivos: El objetivo de la presente revisión fue sintetizar la evidencia disponible sobre el papel que ejercen las pruebas de detección de antígenos y de detección de ácidos nucleicos en el diagnóstico de la malaria y enfermedad de Chagas. Así mismo, se establece como objetivo secundario ilustrar la prueba patrón de oro para cada una de estas enfermedades.
Métodos: Se realizó una revisión bibliográfica de artículos científicos a través de la búsqueda en la base de datos científica PubMed, en la que se llevó a cabo dos estrategias de búsqueda: ”Malaria AND laboratory diagnosis“ y ”Chagas disease AND laboratory diagnosis“.
Resultados: Se reflejó en cada una de las pruebas diagnósticas su utilidad en la práctica clínica, sus ventajas e inconvenientes, los fundamentos en los que están basados y la manera de llevarlos a la práctica, así como los productos existentes en el mercado y algún que otro subtipo de prueba de relevancia a destacar. Por otro lado, se destacó el papel de la prueba patrón de oro de cada una de las enfermedades.
|
Prueba de detección de antígenos (PDR) |
Prueba de detección de ácidos nucleicos (PCR) |
|
|
Características |
Prueba inmunocromatográfica basada en tiras reactivas de flujo lateral de detección de antígenos específicos mediante anticuerpos. |
Método molecular basado en las propiedades de las ADN polimerasas de origen bacteriano termoestables para amplificar pequeños fragmentos de ADN de interés mediante distintos cambios de temperatura y exposición. |
|
Utilidad |
En entornos endémicos de escasos recursos y sin acceso a personal y/o instalaciones, juega un papel principal en el diagnóstico de parasitemias, siendo alternativa al diagnóstico tradicional. |
Utilidad para estudios epidemiológicos, en entornos de investigación o para confirmar otros hallazgos de laboratorio. |
|
En entornos no endémicos es útil para el diagnóstico preliminar, pudiendo ser herramienta para el autodiagnóstico. |
Útil para el diagnóstico en situaciones de trasplante de órganos de un donante infectado y reactivación de la enfermedad en pacientes inmunodeprimidos y evaluación de la respuesta al tratamiento para la erradicación del parásito. |
|
|
Diana |
Malaria: - Proteína II rica en histidina del P. falciparum (HRP-2). - Lactato deshidrogenasa del Plasmodium (pLDH). - Aldolasa del Plasmodium. Enfermedad de Chagas: detección de diferentes compuestos antigénicos de glicoproteínas de membrana y citoplasmáticas del T. cruzi. |
Malaria: |
|
El gen del ARNr de la subunidad pequeña 18S es el objetivo más utilizado. |
||
|
Enfermedad de Chagas: Secuencias de ADN satélite (SatDNA) o ADN minicírculo de cinetoplástido (kDNA) altamente repetitivas son las que aportan mejor rendimiento diagnóstico. |
||
|
Ventajas |
Resultados rápidos, facilidad de uso e interpretación, manejo sencillo, buena sensibilidad y especificidad, económico, implementable en zonas remotas, producible en masa, no requerimiento de ningún equipo especial y ausencia de necesidad de personal cualificado. |
Sensibilidad mayor en comparación con otras pruebas diagnósticas. Altamente sensibles y específicas para la identificación de los parásitos hasta el nivel de especie. Prueba cualitativa y cuantitativa con capacidad de detección de niveles bajos de parasitemia, detección de coinfecciones multiparasitarias, capacidad de procesar muchas muestras a la vez y capacidad para detectar cepas resistentes a los medicamentos y reactivación de la enfermedad. |
|
Inconvenientes |
Menos sensible en comparación con los métodos de diagnóstico molecular, sensibilidad significativamente más baja para distintas especies de parásitos o para niveles bajos de parasitemia, sensibilidad en mujeres embarazadas puede disminuir debido al secuestro de antígenos en la circulación placentaria y existencia de reacciones cruzadas con otros microorganismos. |
Elevado consumo de tiempo y coste, alta complejidad, poca capacidad de reproducibilidad, requerimiento de instalaciones de laboratorio y personal capacitado y dependiente de determinadas condiciones de recolección, conservación y transporte de la muestra, así como de las condiciones de termociclado. |
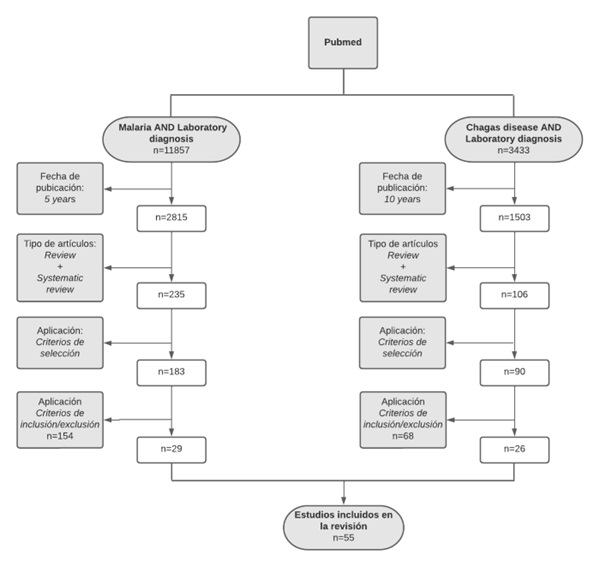
Conclusiones: Las pruebas de detección de antígenos se aplican en aquellas regiones endémicas, rurales y/o de bajos recursos, en los que no existan gran disponibilidad de medios y/o profesionales, siendo útiles en pacientes sintomáticos, con altos niveles de parasitemia detectables. Por su parte, las pruebas de detección de ácidos nucleicos se aplican, de forma general, en aquellas regiones no endémicas o con suficientes recursos para asumir el coste en personal y materiales para su realización, donde su utilidad reside en los pacientes que se presentan de forma asintomática y/o con bajos niveles de parasitemia detectables. En cuanto a la pruebas patrón de oro, el examen microscópico continúa siéndolo para la malaria, mientras que para la enfermedad de Chagas dependerá de la fase en la que se encuentre la enfermedad.
Bibliografía
- Ragavan KV, Kumar S, Swaraj S, Neethirajan S. Advances in biosensors and optical assays for diagnosis and detection of malaria. Biosens Bioelectron. 2018;105(1):188-210.
- Mathison BA, Pritt BS. Update on malaria diagnostics and test utilization. J Clin Microbiol. 2017;55(7):2009-17.
- Goh B, Ching K, Soares Magalhães RJ, Ciocchetta S, Edstein MD, Maciel-De-freitas R, et al. The application of spectroscopy techniques for diagnosis of malaria parasites and arboviruses and surveillance of mosquito vectors: A systematic review and critical appraisal of evidence. PLoS Negl Trop Dis. 2021;15(4):1-24.
- Kamaliddin C, Sutherland CJ, Houze S, Cottrell G, Briand V, Castaneda Mogollon D, et al. The Role of Ultrasensitive Molecular Methods for Detecting Malaria-The Broader Perspective. Clin Infect Dis. 2021;73(6):1387-90.
- Singhi P, Saini AG. Fungal and Parasitic CNS Infections. Indian J Pediatr. 2019;86(1):83-90.
- Amir A, Cheong FW, De Silva JR, Lau YL. Diagnostic tools in childhood malaria. Parasites Vectors. 2018;11(1):53.
- Gitta B, Kilian N. Diagnosis of Malaria Parasites Plasmodium spp. in Endemic Areas: Current Strategies for an Ancient Disease. BioEssays. 2020;42(1):1-12.
- Mitsakakis K, Hin S, Müller P, Wipf N, Thomsen E, Coleman M, et al. Converging human and malaria vector diagnostics with data management towards an integrated holistic one health approach. Int J Env Res Public Heal. 2018;15(2):1-26.
- Hahn WO, Pottinger PS. Malaria in the Traveler: How to Manage Before Departure and Evaluate Upon Return. Med Clin North Am. 2016;100(2):289-302.
- Zhu W, Ling XX, Shang W, Du Y, Liu J, Cao Y, et al. High value of rapid diagnostic tests to diagnose malaria within children: A systematic review and meta-analysis. J Glob Heal. 2020;10(1):1-15.
- Kolluri N, Klapperich CM, Cabodi M. Towards lab-on-a-chip diagnostics for malaria elimination. 2018;18(1):75-94.
- Poostchi M, Silamut K, Maude RJ, Jaeger S, Thoma G. Image analysis and machine learning for detecting malaria. Transl Res. 2018;194(1):36-55.
- Rubio M, Bassat Q, Estivill X, Mayor A. Tying malaria and microRNAs: From the biology to future diagnostic perspectives. Malar J. 2016;15(1):1-14.
- Kotepui M, Kotepui KU. Prevalence and laboratory analysis of malaria and dengue co-infection: A systematic review and meta-analysis. BMC Public Health. 2019;19(1):1-12.
- Muñoz-Saravia SG, Haberland A, Wallukat G, Schimke I. Chronic Chagas’ heart disease: A disease on its way to becoming a worldwide health problem: Epidemiology, etiopathology, treatment, pathogenesis and laboratory medicine. Hear Fail Rev. 2012;17(1):45-64.
- Guarner J. Chagas disease as example of a reemerging parasite. Semin Diagn Pathol. 2019;36(3):164-9.
- Zingales B, Miles MA, Campbell DA, Tibayrenc M, Macedo AM, Teixeira MMG, et al. The revised Trypanosoma cruzi subspecific nomenclature: Rationale, epidemiological relevance and research applications. Infect Genet Evol. 2012;12(2):240-53.
- Zrein M, Chatelain E. The unmet medical need for Trypanosoma cruzi-infected patients: Monitoring the disease status. Biochim Biophys Acta Mol Basis Dis. 2020;1866(3):1-4.
- Avendaño C, Patarroyo MA. Loop-mediated isothermal amplification as point-of-care diagnosis for neglected parasitic infections. Int J Mol Sci. 2020; 1(21):1-32.
- Schijman AG. Molecular diagnosis of Trypanosoma cruzi. Acta Trop. 2018;184(1):59-66.
- Trachtenberg BH, Hare JM. Inflammatory cardiomyopathic syndromes. Circ Res. 2017;121(7):803-18.
- Edwards MS, Stimpert KK, Bialek SR, Montgomery SP. Evaluation and management of congenital chagas disease in the United States. J Pediatr Infect Dis Soc. 2019;8(5):461-9.
- Brasil PE, Castro R, Castro LD. Commercial enzyme-linked immunosorbent assay versus polymerase chain reaction for the diagnosis of chronic Chagas disease: A systematic review and meta-analysis. Mem Inst Oswaldo Cruz. 2016;111(1):1-19.
- Bern C, Messenger LA, Whitman JD, Maguire JH. Chagas disease in the united states: A public health approach. Clin Microbiol Rev. 2019;33(1):1-42.
- Sulleiro E, Muñoz-Calderon A, Schijman AG. Role of nucleic acid amplification assays in monitoring treatment response in chagas disease: Usefulness in clinical trials. Acta Trop. 2019;199(1):1-6.
- Galeano S, Prieto J. Endemic parasitic infections in donors and recipients of stem cell and solid organ transplants: Focus on strongyloidiasis and Chagas disease. Curr Opin Infect Dis. 2021;34(4):323-32.
- Liu Q, Zhou XN. Preventing the transmission of American trypanosomiasis and its spread into non-endemic countries. Infect Dis Poverty. 2015;4(1):1-11.
- De Lana M, Martins-Filho OA. Revisiting the posttherapeutic cure criterion in Chagas disease: Time for new methods, more questions, doubts, and polemics or time to change old concepts? Biomed Res Int. 2015; 2015(1):1-10.
- Ortega-Arroyo A, Flores-Chavez MD, Puente-Alcaraz J. Combined use of two rapid tests for the conclusive diagnosis of Chagas disease: A systematic scoping review. BMJ Open. 2021;11(10):1-7.
- Carlier Y, Truyens C, Deloron P, Peyron F. Congenital parasitic infections: A review. Acta Trop. 2012;121(2):55-70.
- Gomes C, Almeida AB, Rosa AC, Araujo PF, Teixeira ARL. American trypanosomiasis and Chagas disease: Sexual transmission. Int J Infect Dis. 2019;81(1):81-4.
- Truc P, Büscher P, Cuny G, Gonzatti MI, Jannin J, Joshi P, et al. Atypical human infections by Animal Trypanosomes. PLoS Negl Trop Dis. 2013;7(9):1-7.
- Martínez SJ, Romano PS, Engman DM. Precision Health for Chagas Disease: Integrating parasite and host factors to predict outcome of Infection and response to therapy. Front Cell Infect Microbiol. 2020;10(1):210.
- Zingales B. Trypanosoma cruzi genetic diversity: Something new for something known about Chagas disease manifestations, serodiagnosis and drug sensitivity. Acta Trop. 2018;184(1):38-52.
- Haberland A, Munoz Saravia SG, Wallukat G, Ziebig R, Schimke I. Chronic Chagas disease: From basics to laboratory medicine. Clin Chem Lab Med. 2013; 51(2):271-94.
- Kransdorf EP, Zakowski PC, Kobashigawa JA. Chagas disease in solid organ and heart transplantation. Curr Opin Infect Dis. 2014;27(5):418-24.
- Han ET. Loop-mediated isothermal amplification test for the molecular diagnosis of malaria. Expert Rev Mol Diagn. 2013;13(2):205-18.
- Boyce MR, O’Meara WP. Use of malaria RDTs in various health contexts across sub-Saharan Africa: a systematic review. BMC Public Health. 2017;17(1):1-15.
- Feleke DG, Alemu Y, Yemanebirhane N. Performance of rapid diagnostic tests, microscopy, loop-mediated isothermal amplification (LAMP) and PCR for malaria diagnosis in Ethiopia: A systematic review and meta-analysis. Malar J. 2021;20(1):1-11.
- Chen H, Liu K, Li Z, Wang P. Point of care testing for infectious diseases. Clin Chim Acta. 2019;493(1):138-47.
- López L, Koepfli C. Systematic review of Plasmodium falciparum and Plasmodium vivax polyclonal infections: Impact of prevalence, study population characteristics, and laboratory procedures. PLoS One. 2021;16(6):1-15.
- Mahittikorn A, Masangkay FR, Kotepui KU, De Jesus Milanez G, Kotepui M. Comparative performance of PCR using DNA extracted from dried blood spots and whole blood samples for malaria diagnosis: A meta-analysis. Sci Rep. 2021;11(1):1-9.
- Wu HM. Evaluation of the sick returned traveler. Semin Diagn Pathol. 2019;36(3):197-202.
- Gruenberg M, Moniz CA, Hofmann NE, Wampfler R, Koepfli C, Mueller I, et al. Plasmodium vivax molecular diagnostics in community surveys: Pitfalls and solutions. Malar J. 2018;17(1):55.
- Ling XX, Jin JJ, Zhu GD, Wang WM, Cao YY, Yang MM, et al. Cost-effectiveness analysis of malaria rapid diagnostic tests: A systematic review. Infect Dis Poverty. 2019;8(1):1-16.
- Shrestha P, Roberts T, Homsana A, Myat TO, Crump JA, Lubell Y, et al. Febrile illness in Asia: Gaps in epidemiology, diagnosis and management for informing health policy. Clin Microbiol Infect. 2018;24(8):815-26.
- Orish VN, De-Gaulle VF, Sanyaolu AO. Interpreting rapid diagnostic test (RDT) for Plasmodium falciparum. BMC Res Notes. 2018;11(1):850.
- Hemingway J, Shretta R, Wells TNC, Bell D, Djimdé AA, Achee N, et al. Tools and strategies for malaria control and elimination: What do we need to achieve a grand convergence in malaria? PLoS Biol. 2016; 14(3):1-14.
- Zainabadi K. Ultrasensitive diagnostics for low-density asymptomatic Plasmodium falciparum Infections in low-transmission settings. J Clin Microbiol. 2021;59(4):1-11.
- Danwang C, Kirakoya-Samadoulougou F, Samadoulougou S. Assessing field performance of ultrasensitive rapid diagnostic tests for malaria: A systematic review and meta-analysis. Malar J. 2021;20(1):245.
- Pomari E, Piubelli C, Perandin F, Bisoffi Z. Digital PCR: A new technology for diagnosis of parasitic infections. Clin Microbiol Infect. 2019;25(12):1510-6.
- Zamani M, Furst AL, Klapperich CM. Strategies for engineering affordable technologies for point-of-care diagnostics of infectious diseases. Acc Chem Res. 2021;54(20):3772-9.
- MacHado FS, Jelicks LA, Kirchhoff LV, Shirani J, Nagajyothi F, Mukherjee S, et al. Chagas heart disease: Report on recent developments. Cardiol Rev. 2012;20(2):53-65.
- Sguassero Y, Cuesta CB, Roberts KN, Hicks E, Comandé D, Ciapponi A, et al. Course of chronic Trypanosoma cruzi infection after treatment based on parasitological and serological tests: A systematic review of follow-up studies. PLoS One. 2015;10(10):1-23.
- Sguassero Y, Roberts KN, Harvey GB, Comandé D, Ciapponi A, Cuesta CB, et al. Course of serological tests in treated subjects with chronic Trypanosoma cruzi infection: A systematic review and meta-analysis of individual participant data. Int J Infect Dis. 2018;73(1):93-101.






