Las escalas de predicción clínica para embolia de pulmón (EP) determinan la probabilidad pretest y valoran la necesidad de las pruebas para estos pacientes. La infección por coronavirus se asocia a un mayor riesgo de EP, aumentando su gravedad y confiriendo un peor pronóstico. La patogénesis de la EP parece ser diferente en pacientes con y sin infección por SARS-CoV-2. Esta revisión sistemática pretende conocer, revisando la bibliografía disponible, la utilidad de los modelos predictivos desarrollados para EP en pacientes con COVID-19.
MétodosSe realizó una búsqueda bibliográfica en las bases de datos de PubMed, Scopus y EMBASE, incluyendo todos los estudios que comunican datos relacionados con la aplicación de escalas de predicción clínica para EP en pacientes con COVID-19. La calidad de los estudios se evaluó con la escala Newcastle-Ottawa para estudios no aleatorizados.
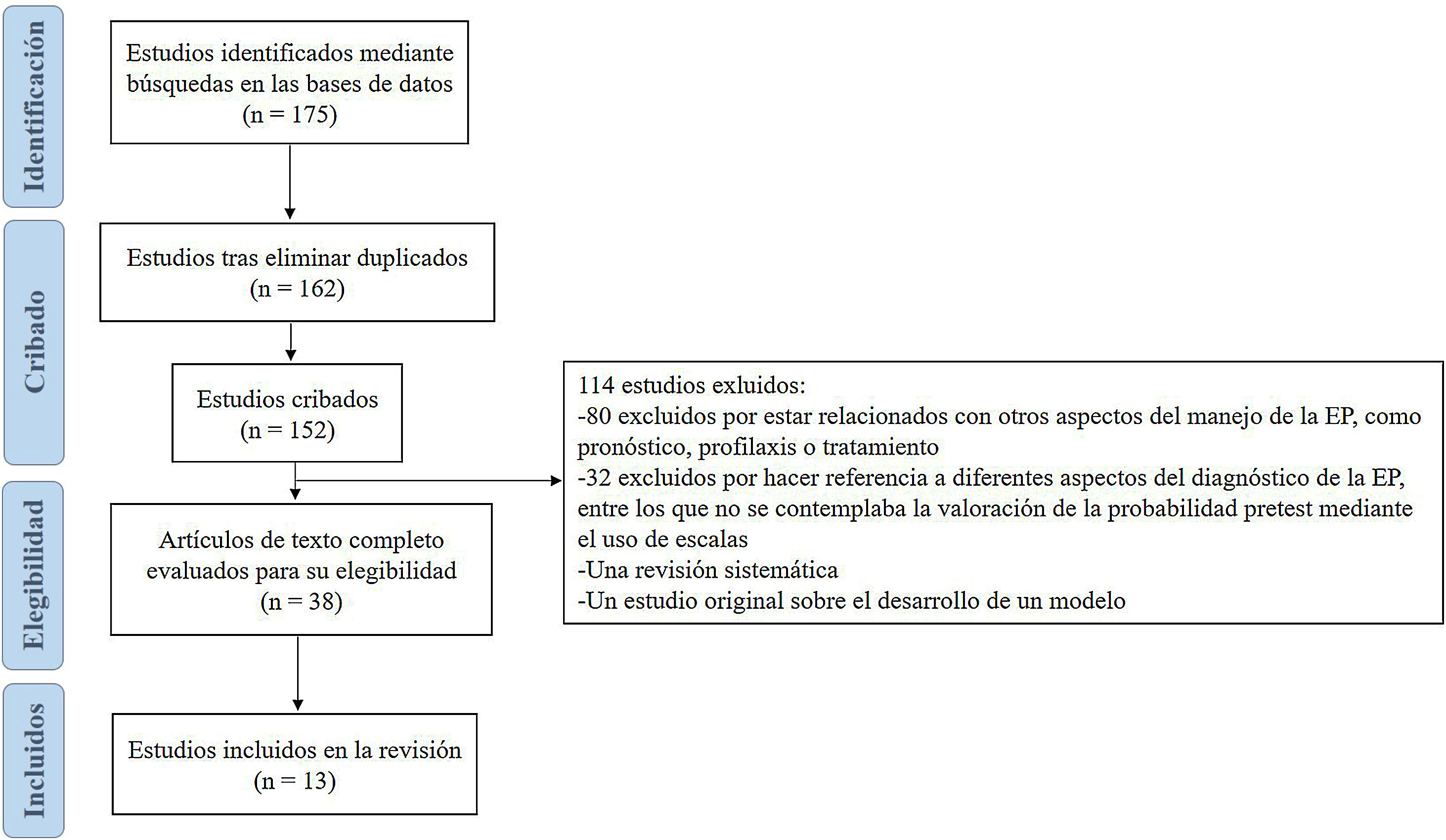
ResultadosSe incluyeron 13 estudios de cohortes que evaluaron cinco modelos predictivos (escala de Wells, puntuación de Ginebra, algoritmo YEARS y las reglas de decisión clínica PERC y PEGeD). Las diversas escalas se aplicaron en 1.187 pacientes con COVID-19. En general, los modelos tuvieron una capacidad predictiva limitada. La escala de Wells de dos categorías con probabilidad clínica baja (o improbable) en combinación con un dímero D<3.000ng/mL o con una ecografía pulmonar a pie de cama normal mostraron una adecuada correlación para excluir la EP.
ConclusiónNuestra revisión sistemática sugiere que las escalas de predicción disponibles para EP desarrolladas en población general no son aplicables a los pacientes con COVID-19, por lo que, de momento, no se recomienda su uso en la práctica clínica como única herramienta de cribado diagnóstico. Se necesitan nuevas escalas de probabilidad clínica para EP validadas en estos pacientes.
Clinical prediction models determine the pre-test probability of pulmonary embolism (PE) and assess the need for tests for these patients. Coronavirus infection is associated with a greater risk of PE, increasing its severity and conferring a worse prognosis. The pathogenesis of PE appears to be different in patients with and without SARS-CoV-2 infection. This systematic review aims to discover the utility of probability models developed for PE in patients with COVID-19 by reviewing the available literature.
MethodsA literature search on the PubMed, Scopus, and EMBASE databases was carried out. All studies that reported data on the use of clinical prediction models for PE in patients with COVID-19 were included. Study quality was assessed using the Newcastle-Ottawa scale for non-randomized studies.
ResultsThirteen studies that evaluated five prediction models (Wells score, Geneva score, YEARS algorithm, and PERC and PEGeD clinical decision rules) were included. The different scales were used in 1,187 patients with COVID-19. Overall, the models showed limited predictive ability. The two-level Wells score with low (or unlikely) clinical probability in combination with a D-dimer level <3000ng/mL or a normal bedside lung ultrasound showed an adequate correlation for ruling out PE.
ConclusionsOur systematic review suggests that the clinical prediction models available for PE that were developed in the general population are not applicable to patients with COVID-19. Therefore, their use is in clinical practice as the only diagnostic screening tool is not recommended. New clinical probability models for PE that are validated in these patients are needed.
Artículo
Diríjase desde aquí a la web de la >>>FESEMI<<< e inicie sesión mediante el formulario que se encuentra en la barra superior, pulsando sobre el candado.
Una vez autentificado, en la misma web de FESEMI, en el menú superior, elija la opción deseada.

>>>FESEMI<<<