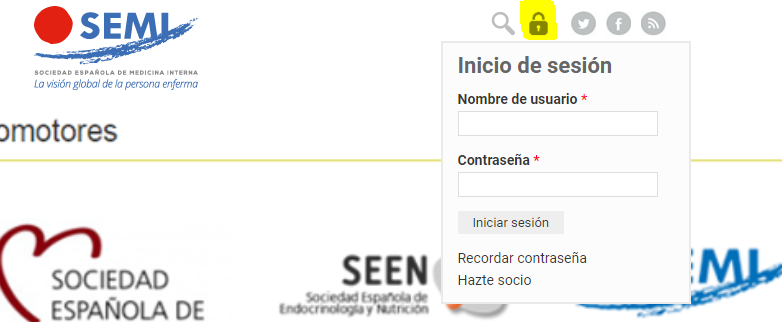
Fig. 1. El efecto incretina es el fenómeno por el cual la ingesta de glucosa por vía oral produce un incremento en la secreción de insulina superior a la administración de cantidades similares de glucosa por vía intravenosa (VI). En este estudio se determinaron los niveles de péptido C como medida de la secreción insulínica. Los datos se presentan como medias ± error estándar. Adaptada de Nauck et al 20.
TABLA 1. Características del polipéptido insulinotrópico dependiente de la glucosa (GIP) y del péptido 1 análogo al glucagón (GLP-1)
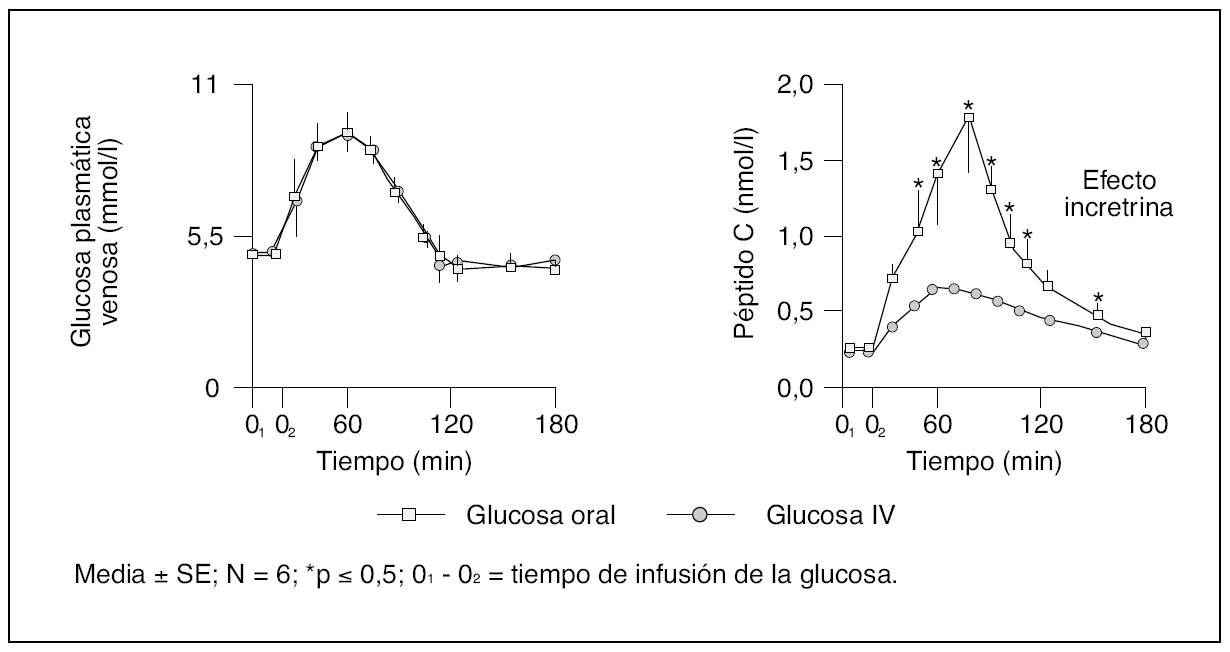
Fig. 2. Representación esquemática de los efectos del péptido 1 análogo al glucagón (GLP-1) en humanos y sus implicaciones en la homeostasis de la glucosa. Adaptada de Flint A, et al; Larson H, et al; Nauck MA, et al; Drucker DJ y Linnebjerg, et al.
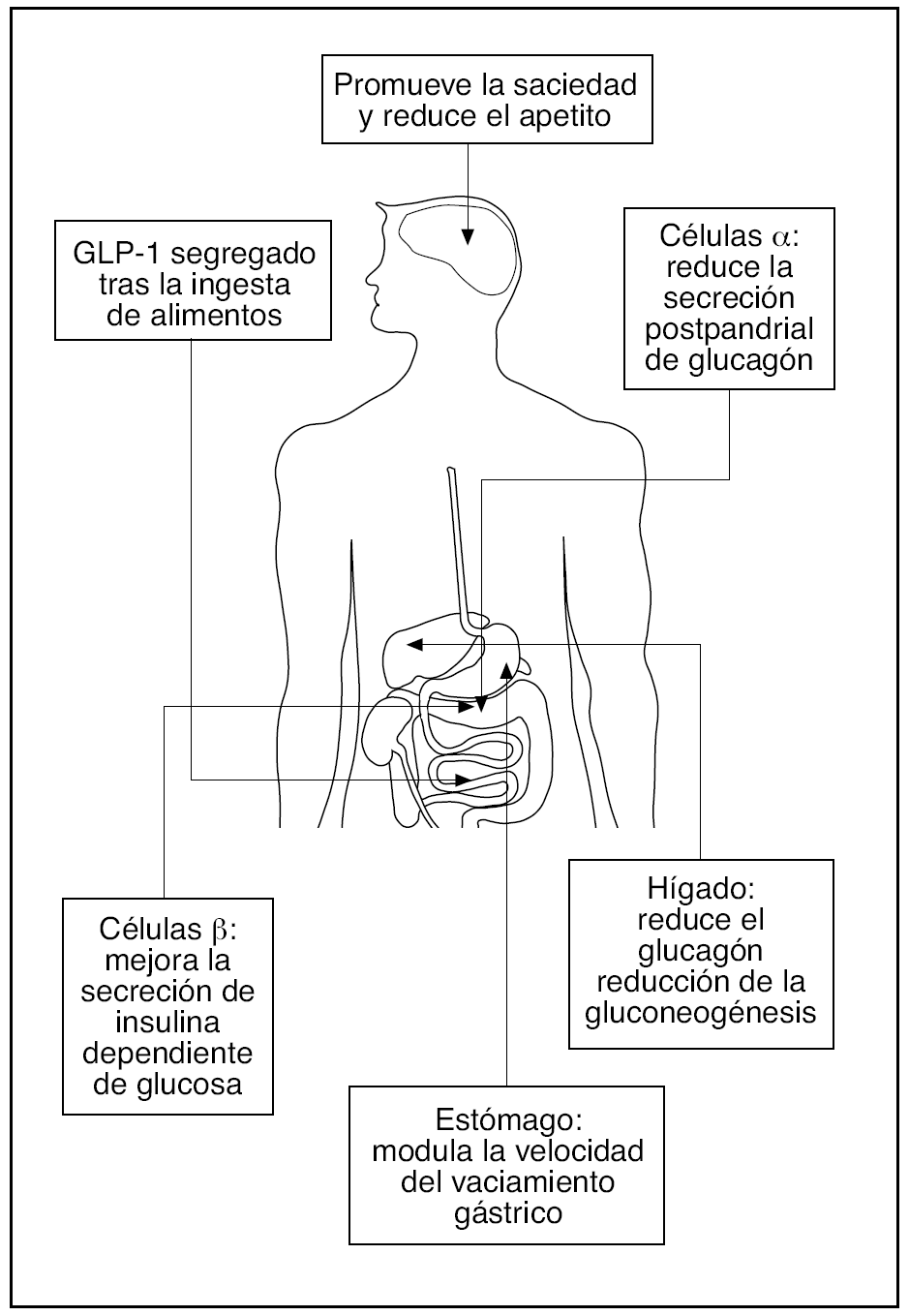
Fig. 3. Secuencia de aminoácidos de las formas principales y biológicamente activas de la hormona incretina del péptido 1 análogo al glucagón (GLP-1) (GLP-1[7-37] y GLP-1[7-36]) amida y de los agentes en desarrollo con acción incretina para el tratamiento de la diabetes mellitus (DM) tipo 2. Los aminoácidos idénticos y en la misma posición que en la secuencia natural del GLP-1 humano se muestran en blanco y los aminoácidos diferentes en gris. Modificada de Nauck M y Meier JJ 89.
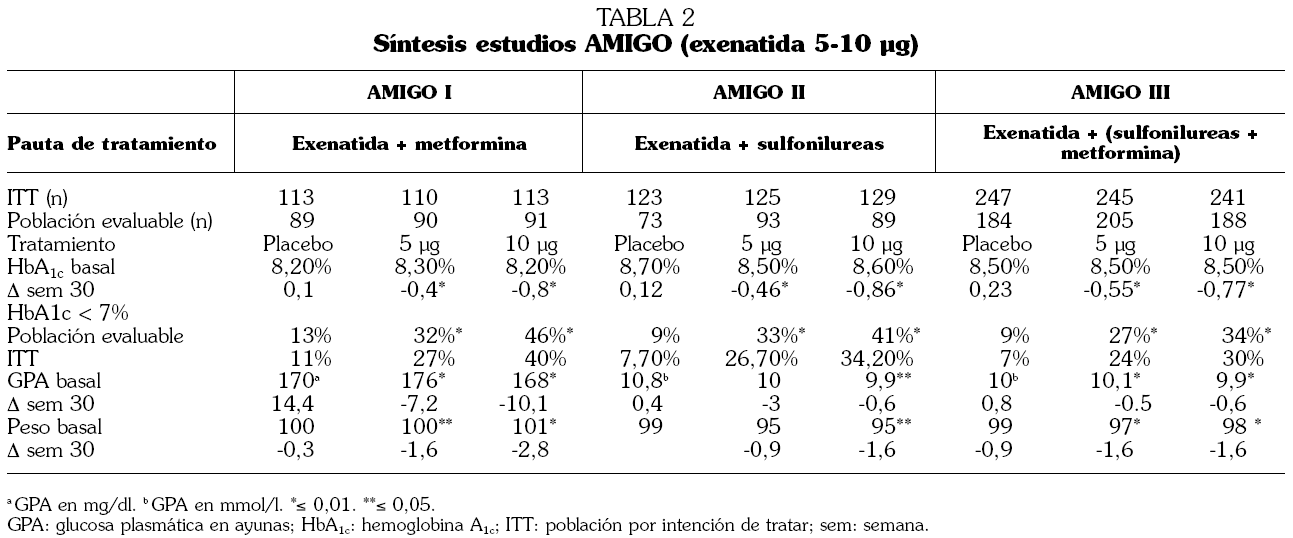
TABLA 2. Síntesis estudios AMIGO (exenatida 5-10 µg)
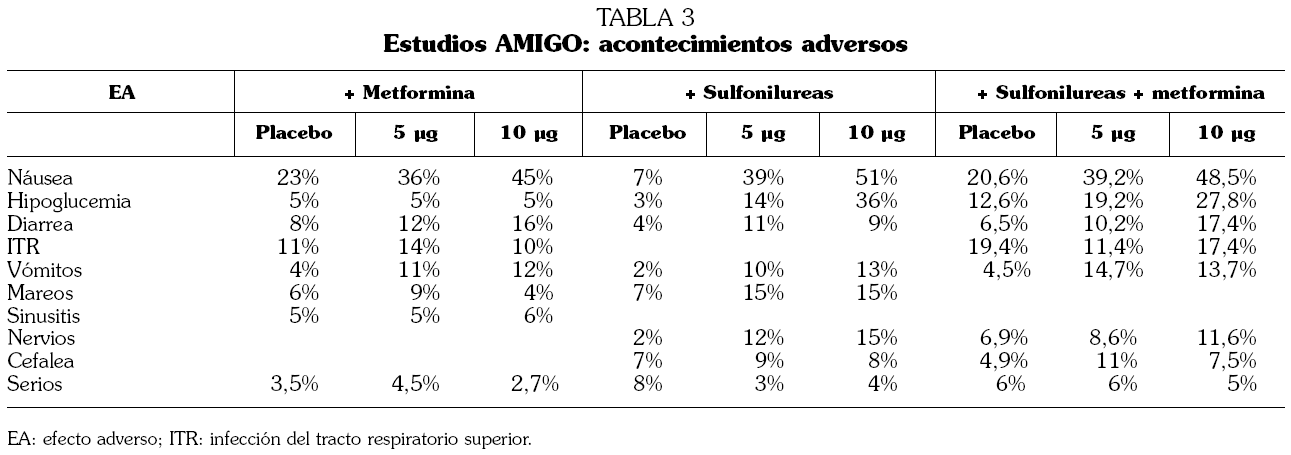
TABLA 3. Estudios AMIGO: acontecimientos adversos
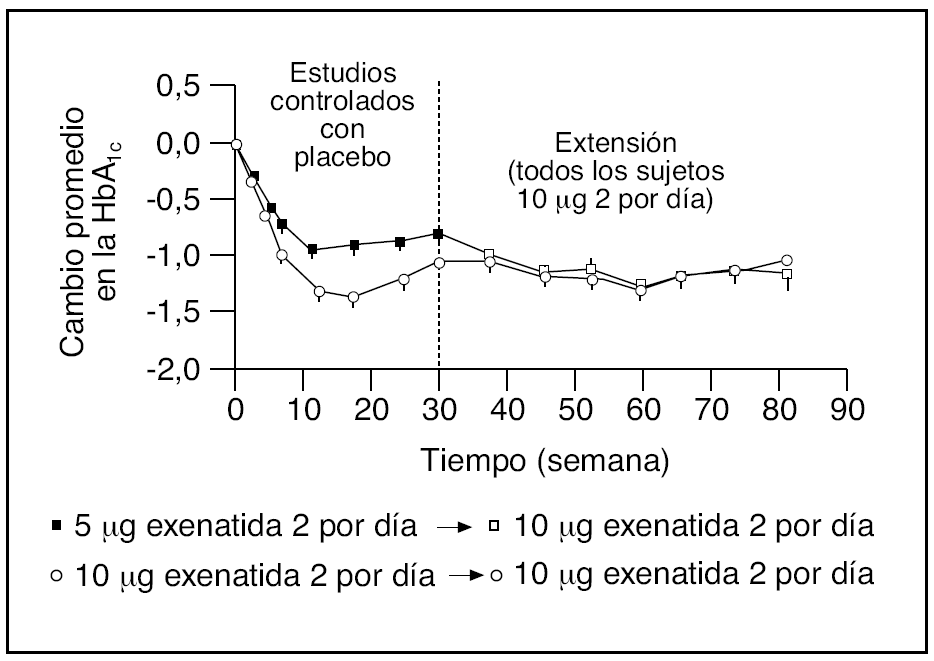
Fig. 4. Efecto del tratamiento con exenatida 5 y 10 µg y metformina, una sulfonilurea o una combinación de ambos, sobre los niveles de hemoglobina A1c (HbA1c) (valor basal: 8,3%) en 314 pacientes con diabetes tipo 2 que completaron un período de seguimiento abierto de 82 semanas (datos combinados). Los datos se presentan como medias ± error estándar.
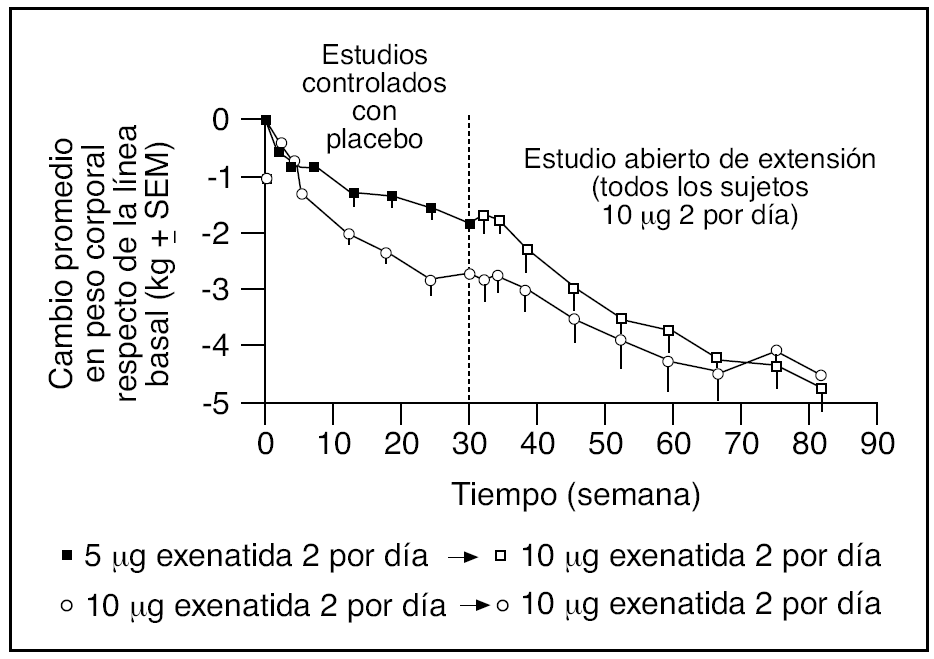
Fig. 5. Efecto del tratamiento con exenatida 5 y 10 µg y metformina, una sulfonilurea o una combinación de ambos, sobre el peso corporal (valor basal: 99,4 kg) en 314 pacientes con diabetes tipo 2 que completaron un período de seguimiento abierto de 82 semanas (datos combinados). Los datos se presentan como medias ± error estándar.