Desde el inicio del brote del nuevo coronavirus en diciembre de 2019 en la ciudad de Wuhan1, son muchos los síntomas que se han ido describiendo hasta la actualidad, siendo lo más reconocible la sintomatología respiratoria. Hay estudios que han evidenciado complicaciones cardiológicas, digestivas o renales, entre otras2.
El análisis más amplio realizado hasta la fecha en referencia a las manifestaciones del sistema nervioso se ha llevado a cabo por Mao et al.3 donde analizaron a 214 pacientes hospitalizados de los cuales el 36,4% de ellos tenían manifestaciones del sistema nervioso central incluyendo anosmia, cefalea, mareo, ageusia o accidente cerebrovascular (isquemia o hemorragia) entre otros. El desarrollo de síndrome de Guillain-Barré y Miller Fischer también se ha reportado en el contexto de infección por SARS-CoV-24,5.
Aunque la asociación del síndrome de Guillain-Barré con vacunas como la antigripal está descrita6, en la actualidad solo hay constancia en la literatura médica de un caso relacionado tras la vacunación con vacuna de mRNA7 y otro tras adenovirus8.
Nosotros presentamos los dos primeros casos de Guillain-Barré descritos en la literatura en los que coinciden este síndrome, vacunación e infección por SARS-CoV-2.
Caso 1. Se trata de un varón de 77 años sin antecedentes de interés. El paciente ingresa el 13 de marzo de 2021 por neumonía COVID-19 con afectación leve del parénquima pulmonar y datos de hiperinflamación. Estuvo en tratamiento con dexametasona con buena evolución posterior tras lo que se deriva al alta seis días más tarde. Dos semanas después recibe la primera dosis de vacunación frente al coronavirus (BNT162b2), recibiendo la misma el día 5 de abril de 2021. A las 72 horas comienza con un cuadro de debilidad en miembros inferiores y edematización progresiva de los mismos. Días posteriores se añade dolor de características neuropáticas en miembro inferior izquierdo.
Consulta en Urgencias el 27 de abril de 2021 por empeoramiento del cuadro con imposibilidad para la deambulación. A nivel neurológico, presentaba abolición de reflejos bilateralmente a nivel de miembros inferiores, desaparición de la sensibilidad epicrítica y protopática, así como disminución de la fuerza en la flexo-extensión de ambos pies y flexión de la pierna (2-3/5). Presentaba edema con fóvea hasta tercio medio de ambas piernas. El resto de la exploración física fue anodina.
En las pruebas complementarias iniciales, destaca elevación de reactantes de fase aguda (PCR 233mg/dL) y dímero-D (8,09mg/L). Se realizó punción lumbar mostrando líquido claro sin aumento de presión y pleocitosis linfocitaria (proteínas 39mg/dL y 1 célula). El estudio de autoinmunidad fue negativo, incluyendo los anticuerpos antigangliósido.
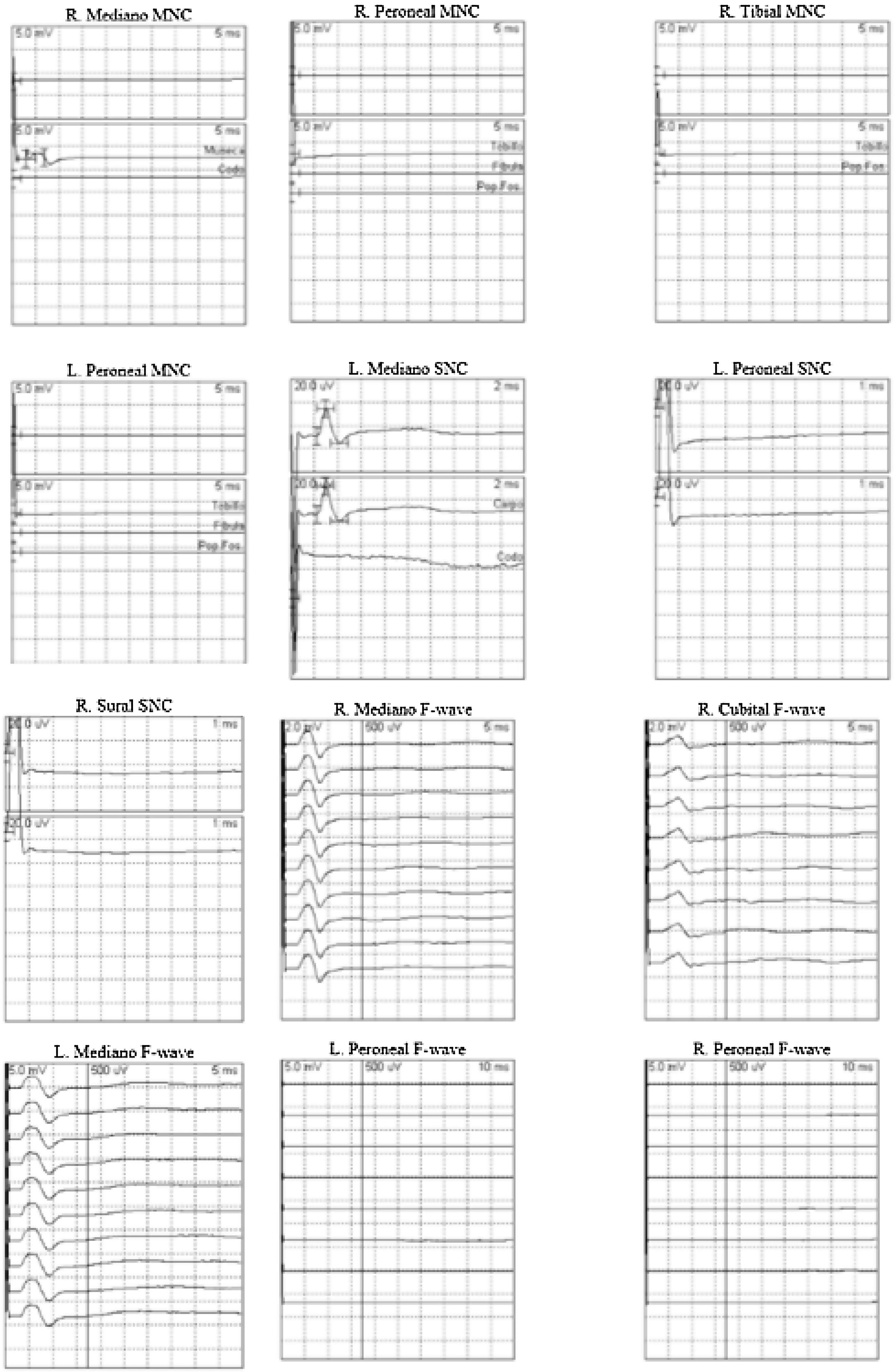
Se realizó el estudio neurofisiológico que confirma la sospecha clínica inicial de síndrome de Guillain-Barré tipo neuropatía sensitivo-motora axonal aguda (AMSAN) (fig. 1). A las pocas horas, se produce un empeoramiento a nivel respiratorio con desaturación y trabajo respiratorio, por lo que se inició tratamiento con inmunoglobulinas intravenosas (400mg/kg/día) y, posteriormente, plasmaféresis dada la refractariedad, con buena evolución posterior.
Resumen del estudio neurofisiológico del paciente número 1. No se obtienen las conducciones motoras distales correspondientes a los nervios principales de los miembros superiores e inferiores. No se obtienen respuestas «F» en ninguno de los nervios explorados. No se obtienen respuestas sensitivas en los nervios de los miembros inferiores.
L: left (izquierdo); MNC: motor nerve conduction (conducción nerviosa motora); R: right (derecho); SNC: sensitive nerve conduction (conducción nerviosa sensible).
Caso 2. Se trata de un paciente de 62 años de edad, sin antecedentes personales de interés y vacunado con la primera dosis de la vacuna ChAdOx1. A las 72 horas acude a Urgencias por cuadro progresivo de fiebre y dificultad respiratoria precisando intubación orotraqueal durante 8 días por neumonía grave COVID-19 confirmada mediante PCR de exudado nasofaríngeo. A las 24 horas del paso a planta de Medicina Interna comienza con episodio agudo de tetraparesia flácida arrefléxica, hipofonía y nuevamente insuficiencia respiratoria que precisó reintubación.
Se realizó una punción lumbar con salida de LCR claro, a presión normal con una disociación albuminocitológica en el análisis citoquímico con proteínas 48mg/dL y 0 células. Se inició tratamiento con inmunoglobulina iv (dosis de 400mg/kg/d durante 5 días) con rápida mejoría del paciente.
Aunque muchos agentes infecciosos se han asociado con el síndrome de Guillain-Barré, los que más suelen asociarse son Campylobacter jejuni, virus de Epstein Barr, citomegalovirus y virus Zika9. El mecanismo por el que el SARS-CoV-2 induce un Guillain-Barré podría ser mediante la estimulación viral de las células inflamatorias produciendo un síndrome de liberación de citoquinas y, como consecuencia, la creación de procesos inmunomediados que pueden dirigirse hacia la mielina o el axón del nervio periférico, lo que resulta en formas desmielinizantes y axonales.
La debilidad puede variar desde dificultad leve para caminar hasta parálisis casi completa de todos los músculos de las extremidades, faciales, respiratorios y bulbares como en uno de nuestros casos, siendo infrecuente ya que la debilidad muscular motora que requiere soporte ventilatorio se desarrolla en el 10-30% de los casos, la debilidad orofaríngea en el 50% y la oculomotora en el 15% de los casos10,11.
Existe controversia entre el desarrollo de este síndrome y la vacunación frente al coronavirus, ya que aunque hay dos casos previos descritos en la literatura de desarrollo de Guillain-Barré tras la vacunación frente al coronavirus con diferentes tipos de vacunas (ChAdOx1-S y BNT162b2)7,8 algunos autores consideran que no existe relación causal entre ambos12,13.
Actualmente hay muy poca información disponible sobre las manifestaciones neurológicas tras la vacunación frente al coronavirus y sus tasas de incidencia por lo que estudios epidemiológicos y registros de casos futuros deberían dilucidar la incidencia real de las complicaciones neurológicas, sus mecanismos patogénicos y sus opciones terapéuticas.
Aunque con la evidencia actual no se puede demostrar relación causal entre la vacunación y este síndrome, consideramos que las complicaciones neuromusculares podrían darse durante la misma, más aún si existe una infección concomitante a la misma no diagnosticada o ha existido una infección reciente, pudiendo ambas situaciones ser sinérgicas y estímulo para el desarrollo de la polirradiculoneuropatía desmielinizante inflamatoria aguda.
Aunque escasamente descritas es posible que esta complicación esté infradiagnosticada.
Comprender y evaluar las manifestaciones neurológicas tras esta vacunación es importante dado que los síntomas iniciales rara vez se evalúan exhaustivamente y pueden interferir con el pronóstico.
FinanciaciónEl presente manuscrito no ha recibido ninguna financiación.