Protocolos para el manejo de la Enfermedad Tromboembólica Venosa
Más datosLa enfermedad tromboembólica venosa (ETV) es una de las complicaciones más frecuentes y graves de los enfermos médicos hospitalizados, siendo la embolia pulmonar la primera causa de muerte prevenible. La ETV prolonga la estancia hospitalaria, con un mayor consumo de recursos y un aumento del gasto sanitario. Los factores de riesgo para su desarrollo pueden ser intrínsecos al paciente o estar relacionados con la propia hospitalización. Conocer e identificar estos factores, tanto al ingreso como durante la evolución del proceso médico, debe ser una prioridad. La profilaxis de la ETV ha demostrado ser eficaz y eficiente. Su aplicación en el paciente médico conlleva una disminución de la embolia pulmonar mortal, de las trombosis venosas profundas sintomáticas y de la mortalidad en los 3 meses posteriores al alta. La valoración individual y detallada del riesgo-beneficio de esta profilaxis es, por tanto, fundamental. Las heparinas de bajo peso molecular siguen siendo de primera elección en la profilaxis farmacológica de la ETV en los enfermos médicos. En aquellos pacientes en los que el uso de fármacos esté contraindicado se podría plantear el uso de medidas físicas para su prevención.
Venous thromboembolism (VTE) is a prevalent and serious complication in hospitalized medical patients. Pulmonary embolism is the most common preventable cause of hospital death. VTE extends hospitalization, with a higher resource consumption and an increase in healthcare costs. Risk factors for VTE include intrinsic factors and those related to hospitalization. It is important to know and to identify these factors at the moment of hospital admission and during the course of disease. VTE prophylaxis has demonstrated to be an efficient and effective action. Its implementation reduces life-threatening pulmonary embolism, symptomatic deep vein thrombosis and death rate three months after discharge. An individual and detailed assessment of prophylaxis risk-benefit is a priority. In our country, low molecular weight heparins are still the first option for VTE pharmacological prophylaxis. In those patients at high risk of bleeding or in whom anticoagulation is contraindicated mechanical methods could be used.
La enfermedad tromboembólica venosa (ETV) es una de las complicaciones más prevalentes del medio hospitalario. Supone una causa importante de morbimortalidad, complicando y prolongando la estancia de los pacientes ingresados. Además, es una patología muy relevante en los enfermos del área médica, en los que aparece con mayor frecuencia y gravedad que en los pacientes quirúrgicos1. Aunque las cifras pueden oscilar según el país, hay datos que reflejan su importancia:
- •
El riesgo de aparición de ETV en los pacientes hospitalizados por causa médica se sitúa entre el 10 y el 20%1.
- •
Hasta un 70% de los eventos tromboembólicos venosos y casi dos tercios de las embolias de pulmón (EP) fatales aparecen en pacientes hospitalizados no quirúrgicos2. Un estudio publicado en 2005 detectó que 4 de cada 1.000 pacientes hospitalizados desarrollaron ETV durante el ingreso; de estos, casi el 75% eran pacientes ingresados con patología médica3.
- •
Revisiones basadas en autopsias clínicas plantean que en torno a un 10% de las muertes hospitalarias se producen por EP4.
- •
Estudios epidemiológicos han demostrado que antes de la instauración de la profilaxis farmacológica en los pacientes hospitalizados, hasta el 60% de la ETV estaba relacionada con el ingreso o aparecía en los 3 meses posteriores al alta5.
- •
La prevalencia de ETV relacionada con la hospitalización en servicios de Medicina Interna en los que no se realiza una adecuada profilaxis puede alcanzar el 25%. En determinadas patologías, como en el ictus o la insuficiencia cardíaca, puede llegar hasta el 40-60%6.
- •
La profilaxis farmacológica ha demostrado ser efectiva y segura en diferentes metaanálisis de pacientes médicos hospitalizados. Su indicación conlleva una disminución de las EP fatales y de las trombosis venosas profundas (TVP) sintomáticas7.
- •
Las estrategias para la prevención de la ETV, como las llevadas a cabo en el Sistema Nacional de Salud británico, han supuesto un descenso de más del 15% en la mortalidad por ETV a los 90 días del alta8.
- •
La aparición de ETV hospitalaria conlleva un mayor consumo de recursos y un aumento del gasto sanitario. La profilaxis ha demostrado ser eficiente, teniendo en cuenta variables como los procedimientos diagnósticos, terapéuticos y el incremento de la estancia hospitalaria que conlleva su aparición9,10.
En base a estos hallazgos resulta esencial realizar una adecuada prevención de ETV en los pacientes médicos hospitalizados. Para ello es imprescindible:
- 1.
Conocer e identificar los factores de riesgo asociados.
- 2.
Evaluar el riesgo trombótico y hemorrágico, tanto al ingreso como durante la evolución del proceso médico.
- 3.
Conocer las medidas de profilaxis y aplicar la más adecuada.
La ETV aparece como consecuencia de la interacción de múltiples factores. Unos están relacionados con el propio paciente, siendo en su mayoría permanentes. Otros con la patología aguda intercurrente y con el entorno con el que interactúa (hospital), por lo que se considerarían temporales.
En prácticamente todos los pacientes hospitalizados se identifica al menos un factor de riesgo para el desarrollo de ETV y hasta el 40% presentan 3 o más11. Para los pacientes médicos hospitalizados el American College of Chest Physicians (ACCP) estableció como factores de alto riesgo para ETV la insuficiencia cardíaca grado III-IV de la NYHA, la sepsis y la enfermedad pulmonar obstructiva crónica (EPOC) descompensada; como factores complementarios, la edad avanzada, el antecedente de ETV, el ictus con parálisis de miembros inferiores, la presencia de cáncer activo, el infarto agudo de miocardio y la inmovilización en cama1. Las últimas guías de las Sociedades Europeas de Cardiología y Respiratorio12 para el manejo de la EP enumeran los factores predisponentes para la aparición de ETV clasificándolos en función del riesgo: alto, moderado o bajo (tabla 1).
Factores de riesgo para la enfermedad tromboembólica venosa (ETV)
| Riesgo alto (OR>10) |
|---|
| Fractura de extremidad inferior |
| Hospitalización por insuficiencia cardíaca o fibrilación/flutter auricular en los últimos 3 meses |
| Prótesis de cadera o rodilla |
| Traumatismo mayor |
| Infarto agudo de miocardio en los últimos 3 meses |
| ETV previa |
| Lesión en médula espinal |
| Riesgo moderado (OR 2-9) |
|---|
| Cirugía de rodilla por artroscopia |
| Enfermedad autoinmune |
| Transfusión hemática |
| Catéter venoso central |
| Cables y catéteres intravenosos |
| Quimioterapia |
| Insuficiencia cardíaca congestiva o insuficiencia respiratoria |
| Fármacos estimulantes de eritropoyesis |
| Terapia hormonal sustitutiva (dependiendo del tipo) |
| Fertilización in vitro |
| Anticonceptivos orales |
| Puerperio |
| Infecciones (sobre todo neumonía, tracto urinario y VIH) |
| Enfermedad inflamatoria crónica intestinal |
| Cáncer (mayor riesgo en enfermedad metastásica) |
| Ictus con parálisis |
| Trombosis venosa superficial |
| Trombofilias |
| Riesgo débil (OR<2) |
|---|
| Encamamiento >3 días |
| Diabetes mellitus |
| Hipertensión arterial |
| Inmovilización debido a sedestación (viajes prolongados) |
| Edad avanzada |
| Cirugía laparoscópica |
| Obesidad |
| Embarazo |
| Venas varicosas |
Fuente: Konstantinides et al.12.
En el paciente hospitalizado con patología médica, una revisión publicada por Barbar y Prandoni13 selecciona aquellos factores que se han relacionado con un mayor riesgo de presentar ETV. Se enumeran en la tabla 2.
Factores de riesgo para la enfermedad tromboembólica venosa (ETV) en el paciente médico hospitalizado
| ETV previa |
| Inmovilización o reposo en cama |
| Edad superior a 75 años |
| Trombofilia conocida |
| Cáncer |
| Patología infecciosa aguda |
| Neumonía |
| Traumatismo en los 3 meses previos |
| Insuficiencia cardíaca |
| Edema de miembros inferiores |
| ACV con hemiplejía |
| Catéter venoso central |
| Trombocitosis >350.000/mm3 |
Fuente: Barbar y Prandoni13.
De entre todos estos factores destaca el reposo, tanto por su frecuencia como por tratarse de un predictor de riesgo para la aparición de ETV. Se ha observado que el encamamiento prolongado más allá de 2 semanas aumenta hasta en 5 veces la posibilidad de desarrollar eventos trombóticos venosos en pacientes mayores de 65 años14. Además, en aquellos pacientes médicos con movilidad reducida, el riesgo de ETV se multiplica por 315. Existen variaciones en cuanto a la definición del reposo/inmovilización y a su peso como factor predisponente para la ETV16. Las principales guías y escalas lo establecen como aquel que conlleva un encamamiento total durante al menos 3 días, con uso del baño como única movilidad («bathroom privileges»)7,12.
Dentro de los pacientes médicos, dos grupos se consideran de especial riesgo:
- a)
Ictus: la ETV es una complicación frecuente, con una prevalencia de hasta el 10%, sobre todo en aquellos con parálisis de miembros inferiores e inmovilización17. Se ha observado un mayor riesgo entre el segundo y el séptimo día tras el cuadro agudo, sobre todo en la extremidad paralizada18.
- b)
Enfermos ingresados en Unidades de Cuidados Intensivos (UCI): presentan múltiples factores predisponentes y pueden desarrollar ETV incluso con profilaxis. La evaluación del riesgo debe ser exhaustiva, tanto al ingreso como durante la evolución diaria. Es importante destacar que estos pacientes pueden presentar complicaciones hemorrágicas, siendo necesario valorar cuidadosamente el riesgo-beneficio de la profilaxis farmacológica19.
La ETV que aparece en los pacientes ingresados por patologías médicas tiene un comportamiento diferente a la que se desarrolla en los pacientes quirúrgicos: es más frecuente, conlleva un peor pronóstico y ha demostrado un mayor número de complicaciones hemorrágicas20. Pese a ello los pacientes médicos reciben menos profilaxis que los quirúrgicos, como han demostrado múltiples estudios realizados en hospitales españoles. En el año 2006, Nieto et al.21 publicaron un trabajo en el que se analizó el riesgo de ETV y la profilaxis antitrombótica en 20 centros hospitalarios que habían participado en el estudio internacional ENDORSE. Para ello se utilizaron las guías y las recomendaciones de la 7.a Conferencia del ACCP. Encontraron que solo el 64% de los enfermos médicos recibieron profilaxis, frente al 84% de los quirúrgicos; además, casi el 29% de los pacientes considerados de alto riesgo de ETV, especialmente en plantas médicas, no recibieron ningún tipo de tromboprofilaxis (TP). En un estudio posterior, en el que se compararon dos guías para la profilaxis en pacientes hospitalizados no quirúrgicos (Guía de Prevención de Enfermedad Tromboembólica venosa en Patología Médica [PRETEMED] y las recomendaciones de la 8ª Conferencia del ACCP), se observó que en casi el 25% de estos pacientes la TP no era la adecuada22. En el año 2015 se publicó un estudio multicéntrico, realizado en hospitales de la comunidad autónoma de Andalucía, en el que se detectó que el 40% de los pacientes ingresados en servicios de Medicina Interna recibían la TP de manera inadecuada23.
La razón principal para esta menor profilaxis parece ser la heterogeneidad de los pacientes médicos. La presencia de procesos agudos de diversa etiología, la pluripatología, la polimedicación y la gran variabilidad de los factores de riesgo dificultan la estandarización de la profilaxis y la elaboración de protocolos de actuación.
Por otra parte, la evaluación del beneficio de la profilaxis farmacológica frente al riesgo hemorrágico es un proceso complejo. Es necesario realizar una selección adecuada de los pacientes. Para ello se ha propuesto el uso de escalas del riesgo, tanto trombótico como hemorrágico.
Las escalas existentes presentan una serie de limitaciones: variabilidad en la validación externa, aplicabilidad restringida a grupos de riesgo elevado, existencia de múltiples variables que pueden complicar su manejo en el ámbito clínico y resultados heterogéneos cuando se comparan entre ellas13,24,25. Pese a todo, estas escalas son herramientas de gran utilidad en la evaluación del riesgo individual de desarrollar ETV de los pacientes médicos ingresados y un apoyo fundamental para la toma de decisiones por parte del clínico.
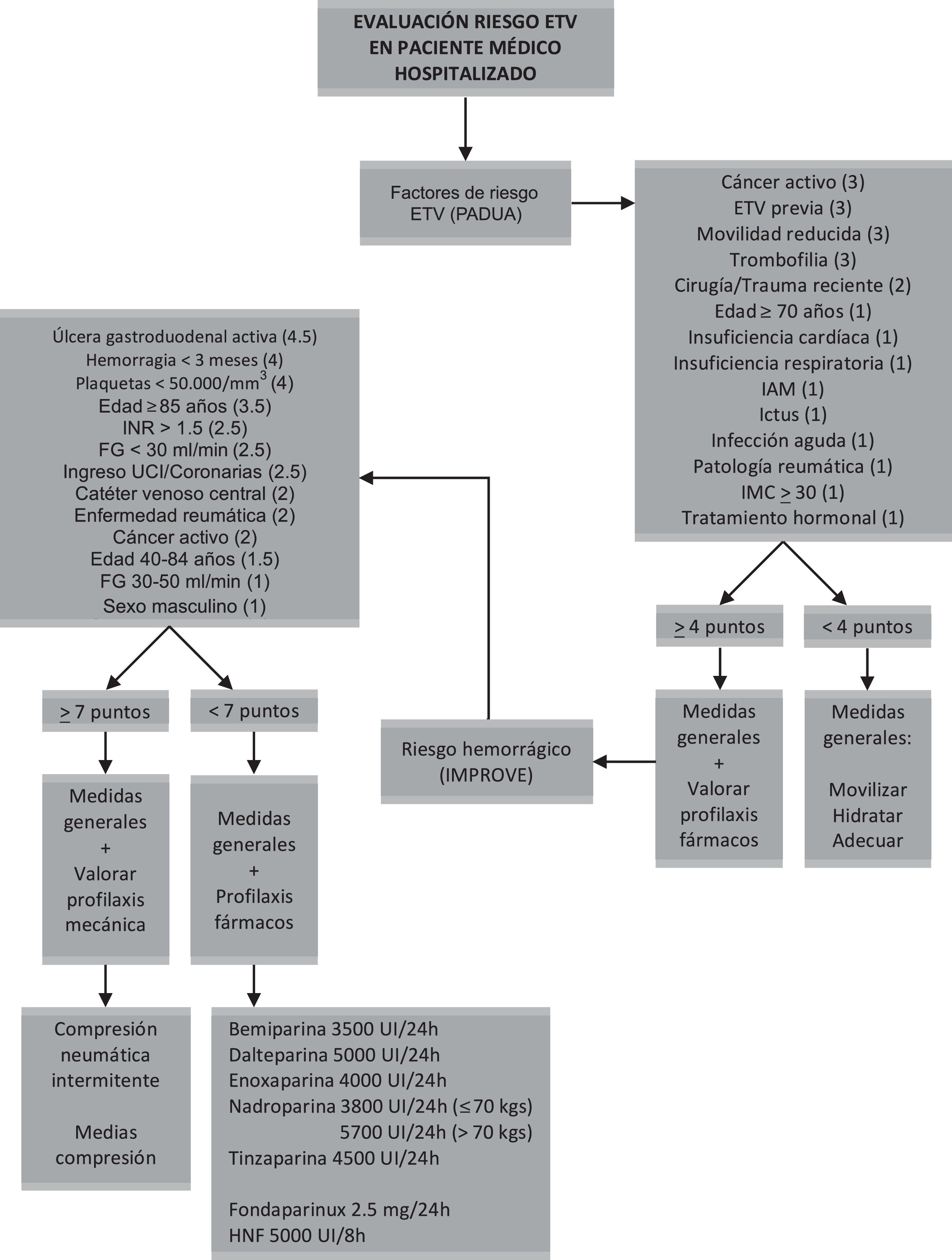
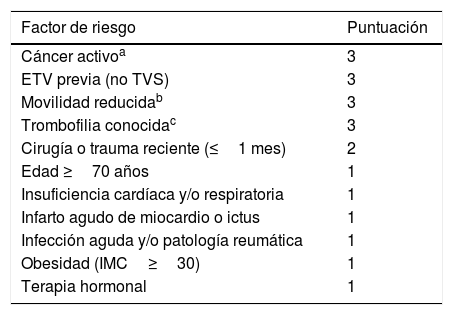
Escalas de riesgo trombóticoEscala de PaduaPropuesta en el año 2010 establece 11 variables26, de las cuales 4 conllevan el mayor riesgo: cáncer activo (definido como aquel con afectación local o metastásica y/o quimioterapia o radioterapia en los 6 meses anteriores), ETV previa (excluyendo la trombosis venosa superficial), movilidad reducida (encamamiento durante al menos 72h, con movilidad solo para ir al baño) y trombofilia conocida (déficit de antitrombina, proteína C o proteína S, factor V Leiden, mutación de la protrombina 20210A y síndrome antifosfolípido). Los pacientes se consideran de alto riesgo si suman >4 puntos y de bajo riesgo con una puntuación <4 puntos (tabla 3).
Escala Predictiva de Padua
| Factor de riesgo | Puntuación |
|---|---|
| Cáncer activoa | 3 |
| ETV previa (no TVS) | 3 |
| Movilidad reducidab | 3 |
| Trombofilia conocidac | 3 |
| Cirugía o trauma reciente (≤1 mes) | 2 |
| Edad ≥70 años | 1 |
| Insuficiencia cardíaca y/o respiratoria | 1 |
| Infarto agudo de miocardio o ictus | 1 |
| Infección aguda y/o patología reumática | 1 |
| Obesidad (IMC≥30) | 1 |
| Terapia hormonal | 1 |
| Puntuación |
|---|
| ≥4 puntos: alto riesgo |
| <4 puntos: bajo riesgo |
Fuente: Gallardo et al.22.
ETV: enfermedad tromboembólica venosa; IMC: índice de masa corporal; TVS: trombosis venosa superficial.
Deriva del registro IMPROVE («The international Medical Prevention Registry on Venous Thromboembolism») e incluye 7 factores clínicos relacionados con complicaciones trombóticas27. Puntuada del 1 al 3, confiere el mayor riesgo al antecedente de ETV previa, seguido de la trombofilia conocida, la parálisis aguda de extremidades inferiores y el cáncer activo (tabla 4). A diferencia de la escala de Padua, la inmovilización se considera de riesgo cuando es de al menos 7 días (cama-sillón). Otro aspecto a destacar es que la escala considera el ingreso en UCI y/o unidad de coronarias.
Escala de riesgo IMPROVE
| Factor de riesgo clínico | Puntuación |
|---|---|
| ETV previa | 3 |
| Trombofilia conocida | 2 |
| Parálisis aguda extremidades inferiores | 2 |
| Cáncer activo | 2 |
| Inmovilización ≥7 díasa | 1 |
| Ingreso en UCI/de Coronarias | 1 |
| Edad >60 años | 1 |
| Puntuación |
|---|
| <2 puntos: bajo riesgo |
| >2 puntos: indicada tromboprofilaxis |
| >4 puntos: riesgo elevado |
Fuente: Spyropoulos et al.27.
ETV: enfermedad tromboembólica venosa; UCI: unidad de cuidados intensivos.
Aún con sus limitaciones, ambas escalas han sido validadas por estudios externos28. Las guías del ACCP recomiendan la escala de Padua para valorar la prevención de la ETV en el paciente no quirúrgico7.
Guía PRETEMEDLa guía de Prevención de la ETV en el paciente médico (PRETEMED), elaborada por la Sociedad Andaluza de Medicina Interna (SADEMI) y la Sociedad Andaluza de Medicina Familiar y Comunitaria (SAMFyC) y avalada por múltiples sociedades científicas españolas, se presentó por primera vez en el año 2003, con una actualización posterior en el 200729. Su objetivo es facilitar la valoración del riesgo de ETV en pacientes médicos hospitalizados y ambulatorios. Para ello establece y cuantifica los diferentes factores de riesgo, ofreciendo unas recomendaciones específicas para su prevención. Esta guía, de amplio uso en nuestro país, ha sido validada en pacientes médicos hospitalizados30.
Escalas de riesgo hemorrágicoLa evaluación del riesgo de sangrado es otro de los aspectos importantes a la hora de plantear la profilaxis farmacológica de la ETV. Como se ha comentado previamente, los enfermos médicos presentan una mayor incidencia de hemorragias. La única escala de la que disponemos para su valoración es la escala de riesgo hemorrágico IMPROVE31. Incluye 13 factores relacionados en la población médica. La úlcera gastroduodenal activa, el sangrado en los 3 meses previos al ingreso, la trombocitopenia <50.000plaquetas/mm3 y la edad >85años son los factores de mayor peso (tabla 5). Una puntuación ≥7 se considera de alto riesgo. En estos pacientes se recomienda extremar las precauciones a la hora de iniciar la profilaxis farmacológica o incluso contraindicarla. Al igual que las de riesgo de ETV, esta escala también tiene limitaciones (validación externa32, variables complejas, puntuaciones heterogéneas).
Escala de riesgo hemorrágico IMPROVE
| Factor de riesgo hemorrágico | Puntuación |
|---|---|
| Úlcera gastroduodenal activa | 4.5 |
| Hemorragia en los 3 meses previos al ingreso | 4 |
| Plaquetas <50.000/mm3 | 4 |
| Edad ≥85 años | 3,5 |
| Insuficiencia hepática (INR>1,5) | 2,5 |
| Insuficiencia renal moderada (FG=30-59 ml/min/1.73 m2) | 2,5 |
| Ingreso en UCI/Unidad de Coronarias | 2,5 |
| Catéter venoso central | 2 |
| Enfermedad reumática | 2 |
| Cáncer activo | 2 |
| Edad 40-84 años | 1,5 |
| Insuficiencia renal moderada (FG = 30-59 ml/min/1.73 m2) | 1 |
| Sexo masculino | 1 |
| Puntuación |
|---|
| ≥7: alto riesgo hemorrágico |
Fuente: Decousus et al.31.
FG: filtrado glomerular; UCI: unidad de cuidados intensivos.
La TP primaria tiene como objetivo prevenir la aparición de fenómenos tromboembólicos venosos, ya sea mediante medidas farmacológicas o utilizando métodos mecánicos.
Tromboprofilaxis farmacológicaEs la medida más habitual en la práctica clínica de los pacientes que ingresan por patologías médicas. Se dispone de 3 opciones:
- •
Heparinas de bajo peso molecular (HBPM)
- •
Fondaparinux
- •
Heparina no fraccionada (HNF)
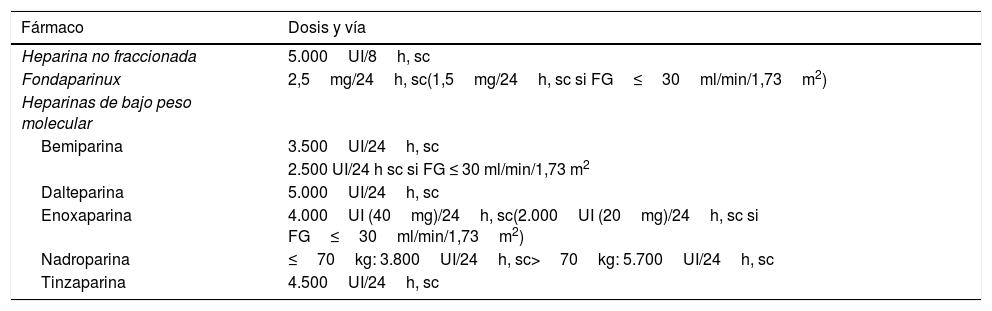
Los estudios han demostrado que el uso de HBPM, fondaparinux o HNF disminuye el riesgo de TVP33. Diversos trabajos han comparado la HNF frente a la HBPM demostrando una eficacia similar, tanto en profilaxis de los eventos trombóticos como en la mortalidad global; sin embargo, la HBPM ha demostrado una menor incidencia de complicaciones hemorrágicas34,35. La HBPM y el fondaparinux tienen mayor biodisponibilidad y semivida, lo que permite su dosificación una vez al día; a diferencia de la HNF, no precisan monitorización mediante controles analíticos. En nuestro medio el uso de la HNF para la TP farmacológica se limita a casos muy seleccionados, siendo la HBPM de primera elección. En la tabla 6 se describen los 3 grupos de fármacos.
Fármacos para tromboprofilaxis farmacológica de la enfermedad tromboembólica venosa
| Fármaco | Dosis y vía |
|---|---|
| Heparina no fraccionada | 5.000UI/8h, sc |
| Fondaparinux | 2,5mg/24h, sc(1,5mg/24h, sc si FG≤30ml/min/1,73m2) |
| Heparinas de bajo peso molecular | |
| Bemiparina | 3.500UI/24h, sc |
| 2.500 UI/24 h sc si FG ≤ 30 ml/min/1,73 m2 | |
| Dalteparina | 5.000UI/24h, sc |
| Enoxaparina | 4.000UI (40mg)/24h, sc(2.000UI (20mg)/24h, sc si FG≤30ml/min/1,73m2) |
| Nadroparina | ≤70kg: 3.800UI/24h, sc>70kg: 5.700UI/24h, sc |
| Tinzaparina | 4.500UI/24h, sc |
La dosis para TP farmacológica es fija e independiente del peso7. En aquellos pacientes con obesidad mórbida (IMC≥35) se desconoce la dosificación más adecuada. Parece razonable aplicarla de manera empírica cada 12h.
Inicio y duración de la TP farmacológicaLa TP farmacológica debe iniciarse de manera precoz en las primeras 48h del ingreso hospitalario. Se mantendrá durante todo el ingreso, con reevaluaciones periódicas del riesgo trombótico y hemorrágico. Es recomendable monitorizar el número de plaquetas regularmente en aquellos pacientes que reciben HBPM para detectar la posible aparición de trombocitopenia inducida por heparina (TIH).
La profilaxis extendida (hasta 5 semanas) tras el alta demostró reducir la aparición de ETV en el estudio EXCLAIM, pero con un aumento significativo del número de eventos hemorrágicos; además, no se encontraron variaciones en la mortalidad global36. Se recomienda valorar de manera individualizada la necesidad de prolongar la TP tras el alta en aquellos casos en los que persistan los factores de riesgo que precisaron su indicación.
Contraindicaciones de la TP farmacológicaSe debe evaluar cuidadosamente la indicación de TP farmacológica en aquellos pacientes con elevado riesgo de sangrado (escala IMPROVE≥7 puntos). Su uso está contraindicado en los casos de sangrado activo (hemorragia digestiva, intracraneal, hemoptisis, etc.).
TP farmacológica en insuficiencia renalEn los pacientes con FG≤30ml/min/1,73m2 se recomienda la reducción de dosis (fondaparinux 1,5mg/24h, bemiparina 2500 UI/24 h, enoxaparina 20mg/24h o nadroparina un 25-33%). Existen evidencias de que la dosis de tinzaparina podría mantenerse hasta FG de 20ml/min/1,73 m2 (aunque no está recomendado su uso para <30 ml/min/1,73m2)37.
Anticoagulantes orales de acción directaEn nuestro país los anticoagulantes de acción directa no están aprobados en la actualidad para la prevención de la ETV en el paciente médico no quirúrgico. Únicamente están indicados en aquellos pacientes sometidos a cirugía de prótesis de cadera o rodilla. Tanto rivaroxabán, apixabán como dabigatrán han demostrado su no inferioridad frente a HBPM, si bien presentaron un incremento significativo de las hemorragias38. En los enfermos oncológicos varias guías de práctica clínica plantean ya el uso de estos fármacos (rivaroxabán o apixabán) para la profilaxis a nivel ambulatorio. Aquellos pacientes que reciben quimioterapia, con riesgo intermedio-alto de ETV (cáncer de páncreas, pulmón o con escala de Khorana≥2) y no tienen riesgo hemorrágico elevado podrían beneficiarse de su uso39.
Otras consideracionesLa realización de una técnica de anestesia neuroaxial (punción lumbar o inserción de catéter) se debe retrasar 12h tras la administración de una dosis profiláctica de HBPM. Una vez realizada deben transcurrir al menos 6h para reiniciar la TP40.
Tromboprofilaxis mecánicaLas medidas de compresión mecánica han demostrado ser eficaces en el paciente quirúrgico con contraindicación para la TP farmacológica por riesgo de sangrado. Sin embargo, su beneficio en el paciente con patología médica no está del todo demostrado. Guías recientes de TP sugieren su uso en aquellos pacientes en los que el riesgo hemorrágico sea muy elevado y por lo tanto se contraindique la TP farmacológica41. Los métodos más habituales son:
- •
Medias de compresión gradual y bombas plantares: no han demostrado claro beneficio en poblaciones de alto riesgo como los pacientes con ictus42.
- •
Compresión neumática intermitente (CNI): los sistemas de CNI previenen la TVP mejorando el flujo sanguíneo en las extremidades inferiores, evitando así la estasis venosa. Aunque las evidencias son limitadas existen estudios que han demostrado reducir la incidencia de ETV, por lo que se considera el método de elección43.
En todos los pacientes médicos ingresados se debe:
- •
Favorecer la movilización precoz tan pronto sea posible.
- •
Asegurar un adecuado estado de hidratación.
- •
Evitar procedimientos que supongan limitación para la movilidad como son el sondaje vesical, la sueroterapia y las medidas de contención física. Adecuar las indicaciones de estas técnicas de manera individualizada y con revisiones periódicas a lo largo del ingreso es una medida elemental.
Con el objetivo de optimizar la profilaxis de ETV en los pacientes médicos hospitalizados, varios estudios han demostrado la utilidad de incluir sistemas de alertas electrónicas y guías de práctica clínica en las historias clínicas digitalizadas44. Estas medidas conllevan una mejora en la adecuación de la TP individualizada. Además, permitirían disminuir la mortalidad relacionada con la ETV en este tipo pacientes, si bien las evidencias disponibles al respecto aún son limitadas45.
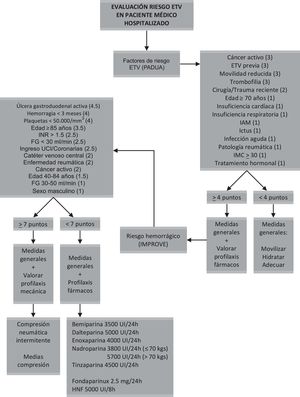
Algoritmo de actuaciónEn la figura 1 se propone un algoritmo a modo de resumen y de carácter práctico para la valoración de la profilaxis de ETV en el paciente médico hospitalizado.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.
Nota al suplementoEste artículo forma parte del suplemento «Protocolos de manejo de la enfermedad tromboembólica venosa. Actualización 2020», que cuenta con la colaboración de Laboratorios Rovi para la impresión y difusión del suplemento.